Das Periodensystem der Elemente ist eine Tabelle, die alle bekannten chemischen Elemente enthält.
Im 19. Jahrhundert begannen Chemiker, bekannte chemische Elemente nach ihren physikalischen und chemischen Eigenschaften zu klassifizieren. 1860 wurde in Karlsruhe der erste Internationale Chemikerkongress mit dem Ziel organisiert, die Kriterien für die Klassifizierung von Elementen zu vereinheitlichen. Dieses Treffen war von entscheidender Bedeutung für die Geschichte der Wissenschaft und den Ursprung der Schaffung der Tabelle, die heute in Lehrbüchern erscheint.
Nach Angaben der International Union of Pure and Applied Chemistry (IUPAC) wurde das Periodensystem der chemischen Elemente am 1. März 1869 geboren.
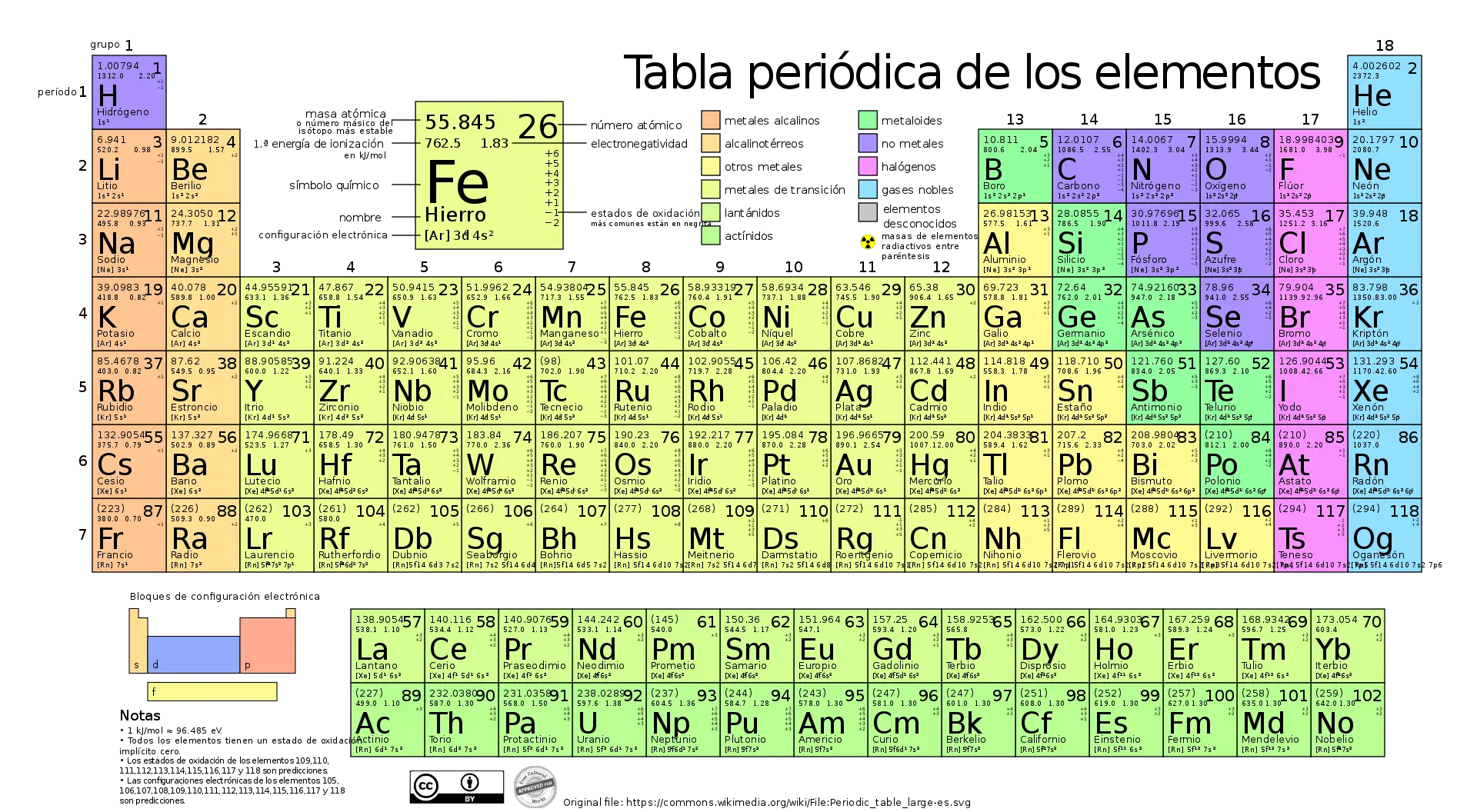
Wie viele chemische Elemente enthält das Periodensystem?
Derzeit enthält das Periodensystem 118 chemische Elemente.
Die letzten Elemente, die in das Periodensystem eingeführt wurden, sind die Elemente 113, 115, 117 und 118. Die Namen dieser neuen Elemente sind Nihonium, Moscovio, Teneso bzw. Oganesón. Diese Eingliederung erfolgte am 01.12.2016.
Wie sind die chemischen Elemente im Periodensystem angeordnet?
Innerhalb des Periodensystems sind die chemischen Elemente nach ihrer Ordnungszahl, also der Anzahl der Protonen im Atomkern, geordnet.
Das Periodensystem ist in Zeilen und Spalten organisiert. Die Spalten werden als Gruppen bezeichnet, während die Zeilen als Perioden bezeichnet werden.
Die Elemente sind so angeordnet, dass Elemente mit ähnlichen elektronischen Konfigurationen übereinander liegen. Es ist auch so angeordnet, dass sich Elemente mit ähnlichem Verhalten in derselben Spalte befinden.
Wozu dient das Periodensystem?
Das Periodensystem wird in der Chemie und anderen Wissenschaften vielseitig verwendet. Die wichtigsten sind:
-
Zeigen Sie die Beziehungen zwischen den verschiedenen chemischen Elementen auf.
-
Sagen Sie die Eigenschaften von Elementen voraus, die gerade entdeckt oder noch nicht synthetisiert wurden.
-
Bietet ein nützliches Bild bei der Analyse des chemischen Verhaltens von Chemikalien.
Periode im Periodensystem
Eine Periode im Periodensystem entspricht einer horizontalen Zeile. Normalerweise sind die klarsten periodischen Trends in den Gruppen zu sehen, jedoch gibt es bestimmte Bereiche der Tabelle, in denen die Trends in horizontaler Richtung stärker ausgeprägt sind.
Die Elemente der gleichen Periode in der Tabelle zeigen Trends im Ionisationspotential, Atomradius und Elektronenaffinität und Elektronegativität.
Von links nach rechts in einer Periode nimmt der Atomradius im Allgemeinen ab. Dies liegt daran, dass in dieser Richtung jedes Element in der Tabelle ein zusätzliches Elektron und Proton hat und die Elektronen sich dem Kern nähern. Diese Verringerung des Atomradius stellt sicher, dass das Ionisationspotential im Laufe der Zeit auch von links nach rechts ansteigt.
Die Elektronegativität wächst ebenso wie das Ionisationspotential. Dieser Anstieg ist darauf zurückzuführen, dass der Kern Elektronen anzieht.
Gruppen oder Familien des Periodensystems
Eine Gruppe oder Familie ist eine Spalte im Periodensystem der chemischen Elemente. Typischerweise weisen Gruppen auffälligere periodische Trends auf als Blöcke und Perioden.
Chemische Elemente, die derselben Gruppe angehören, haben ähnliche chemische Eigenschaften. Außerdem besteht eine deutliche Tendenz zur Erhöhung der Ordnungszahlen. Aber in einigen Teilen der Tabelle können die horizontalen und vertikalen Ähnlichkeiten genauso wichtig sein.
Eigenschaften der Elemente innerhalb der Gruppe
Elemente in derselben Gruppe neigen dazu, Muster von Atomradius, Ionisationspotential und Elektronegativität aufzuweisen. Von oben nach unten nimmt der Atomradius der Elemente pro Gruppe zu, da mehr Elektronen vorhanden sind und die Valenzelektronen weiter vom Atomkern entfernt sind.
Von oben hat jedes chemische Element ein schwächeres Ionisationspotential. Dies liegt daran, dass es einfacher ist, ein Elektron zu entfernen und die Kraft, mit der die Atome befestigt werden, schwächer ist.
Die Elektronegativität von Familien nimmt im Allgemeinen ab, wenn Sie sich in der Tabelle nach unten bewegen. Diese Abnahme ist auf die Zunahme des Abstands zwischen dem Kern und den Valenzelektronen zurückzuführen.
Blöcke des Periodensystems
Die Blöcke sind die spezifischen Regionen des Periodensystems der Elemente. Der Blockname entspricht dem der Schale, die das letzte Elektron enthält.
Im Periodensystem gibt es folgende Blöcke:
-
Der „s“-Block: umfasst die erste und zweite Gruppe, die Wasserstoff, Helium, Alkali- und Erdalkalimetallen entsprechen.
-
Block "p" enthält die letzten sechs Gruppen. Es umfasst unter anderem Edelgase und Halbmetalle.
-
Block "d" umfasst Gruppen zwischen 3 und 12. Dieser Block enthält alle Übergangsmetalle.
-
Block "f" hat keine Gruppennummern. Es wird oft unter dem Rest der Tabelle dargestellt. Das "f" blockiert die Actiniden und Lanthanoide.
Wem wird das Periodensystem zugeschrieben?
Das erste erkennbare Periodensystem wurde 1869 vom russischen Chemiker Dmitri Mendeleev in einer Arbeit mit dem Titel "Principles of Chemistry" veröffentlicht. Die Art und Weise, wie wir chemische Elemente heute organisieren, folgt immer noch dem Vorschlag von Mendelejew.
 Gleichzeitig arbeitete auch der deutsche Chemiker Julius Lothar Meyer, ein zeitgenössischer Konkurrent von Mendelejew, mit der Idee, das erste Periodensystem zu schaffen. Meyer ordnete die Elemente nach den physikalischen Eigenschaften von Atomen an, aber sein Vorschlag war nicht so beliebt.
Gleichzeitig arbeitete auch der deutsche Chemiker Julius Lothar Meyer, ein zeitgenössischer Konkurrent von Mendelejew, mit der Idee, das erste Periodensystem zu schaffen. Meyer ordnete die Elemente nach den physikalischen Eigenschaften von Atomen an, aber sein Vorschlag war nicht so beliebt.
Seit seiner Einführung wurde Mendelejews Periodensystem der Elemente vervollständigt und erweitert, wenn andere Elemente entdeckt oder synthetisiert wurden.
Einige Wissenschaftler glauben jedoch, dass die endgültige Version der Tabelle dank des zu Beginn des 20. Jahrhunderts von Henry Moseley vorgestellten periodischen Gesetzes erreicht wurde.
Dmitri Mendelejews Vorhersagen
Mendeleev entwickelte seine Tabelle, um periodische Trends in den 63 damals bekannten chemischen Elementen aufzuzeigen. Er sagte auch einige Eigenschaften von Chemikalien voraus, die zu diesem Zeitpunkt noch unbekannt waren, von denen er jedoch hoffte, dass sie die Lücken in der Tabelle füllen würden.
Als diese neuen Elemente entdeckt wurden, erwiesen sich seine Vorhersagen als weitgehend richtig.
