
Der Atomkern ist der winzige zentrale Bereich des Atoms mit einer positiven elektrischen Ladung, in dem fast seine gesamte Masse konzentriert ist.
Obwohl es nur einen Bruchteil der Gesamtgröße des Atoms ausmacht, ist sein Einfluss entscheidend für die Definition der chemischen und physikalischen Eigenschaften der Elemente.
Subatomare Teilchen des Kerns
Der Kern besteht aus Protonen und Neutronen, die zusammen als Nukleonen bezeichnet werden. Protonen haben eine positive elektrische Ladung, während Neutronen elektrisch neutral sind. Im einfachsten Wasserstoffkern (Wasserstoff-1) findet man jedoch nur ein Proton ohne Neutronen.
Jedes chemische Element wird durch seine Ordnungszahl (Z) definiert, die der Anzahl der Protonen im Kern entspricht und seine elektrische Gesamtladung bestimmt. Darüber hinaus ist die Massenzahl (A) die Summe von Protonen und Neutronen und liefert ein ungefähres Maß für die Kernmasse.
Zusammensetzung des Kerns und seine Struktur
Fast die gesamte Masse des Atoms befindet sich im Kern, da Elektronen, obwohl sie für chemische Wechselwirkungen unerlässlich sind, im Vergleich zu Protonen und Neutronen eine vernachlässigbare Masse haben. Die Größe des Kerns variiert je nach Element: von etwa 1,75 Femtometern (fm) im Wasserstoffkern bis zu 15 fm in den schwersten Elementen wie Uran.
Die Grundzahlen, die den Atomkern beschreiben, sind:
- Ordnungszahl (Z): Anzahl der Protonen.
- Neutronenzahl (N): Anzahl der Neutronen im Kern.
- Massenzahl (A): Summe aus Protonen und Neutronen, A = Z + N.
Kernkräfte und Bindungen zwischen Protonen
Das Vorhandensein positiv geladener Protonen erzeugt eine starke elektrostatische Abstoßung im Kern. Allerdings hält eine viel stärkere Kraft, die sogenannte starke Kernkraft, die Nukleonen zusammen. Diese Kraft hat eine geringe Reichweite, reicht aber aus, um der Abstoßung zwischen den Protonen entgegenzuwirken.
Bei Kernfusionsreaktionen wird Kernbindungsenergie freigesetzt, die für den Zusammenhalt des Kerns verantwortlich ist. Bei diesen Prozessen wird beim Aufbrechen von Kernbindungen Energie nach Einsteins Gleichung erzeugt:
E=mc 2
Dieser Zusammenhang beschreibt, wie der Massenverlust bei diesen Reaktionen in Energie umgewandelt wird.
Beispiele für Atomkerne in der Kernenergie
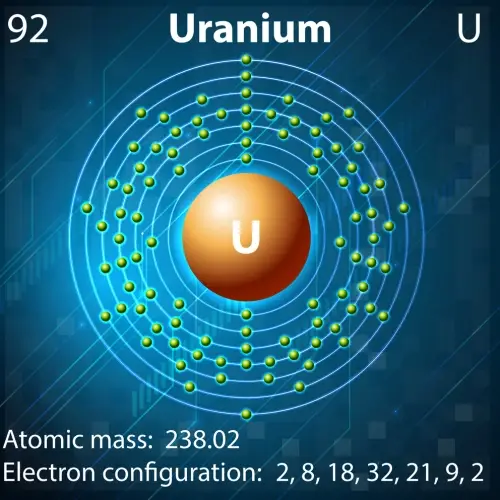 Im Bereich der Kernenergie sind einige Atomkerne aufgrund ihrer einzigartigen Eigenschaften unverzichtbar:
Im Bereich der Kernenergie sind einige Atomkerne aufgrund ihrer einzigartigen Eigenschaften unverzichtbar:
- Uran-235: Dieses Uranisotop ist der Schlüssel zu Kernreaktoren und Atomwaffen. Sein Kern, der aus 92 Protonen und 143 Neutronen besteht, ist hoch spaltbar, was bedeutet, dass er bei Beschuss mit Neutronen in kleinere Kerne zerfallen kann und dabei enorme Energiemengen freisetzt.
- Plutonium-239: Künstlich hergestellt, ist es ein weiterer Kern, der für die Kernspaltung entscheidend ist. Es verfügt über 94 Protonen und 145 Neutronen und wird aufgrund seiner hohen Fähigkeit, Energie freizusetzen, sowohl in Reaktoren als auch in Kernwaffen eingesetzt.
- Deuterium (Wasserstoff-2): Es ist ein Wasserstoffisotop, das in Kernfusionsexperimenten verwendet wird, wo es sich mit Tritium (Wasserstoff-3) verbindet, um saubere Energie freizusetzen. Diese Reaktion ist die Grundlage der Forschung in Fusionsreaktoren wie ITER.
Atommodelle und die Entwicklung der Atomtheorie
Das Verständnis der Atomstruktur hat sich im Laufe der Zeit erheblich weiterentwickelt. Nachfolgend werden die wichtigsten Meilensteine hervorgehoben:
- Dalton-Modell (1808): John Dalton schlug vor, dass alle Materie aus unteilbaren und unsichtbaren Atomen besteht. Dieses Modell berücksichtigte nicht die Existenz des Atomkerns.
- Thomson-Modell (1897): Joseph John Thomson entdeckte das Elektron und schlug vor, dass Atome eine innere Struktur haben. Er postulierte ein Modell, bei dem negative Teilchen (Elektronen) in einer positiven Masse verteilt sind, das sogenannte „Plum-Pudding-Modell“.
- Rutherford-Modell (1911): Ernest Rutherford entdeckte den Atomkern durch das berühmte Goldfolienexperiment. Er stellte fest, dass Atome einen kleinen, dichten Zentralkern haben, der von Elektronen umgeben ist.
- Bohr-Modell (1913): Niels Bohr verfeinerte Rutherfords Modell und schlug vor, dass Elektronen den Kern auf definierten Energieniveaus umkreisen. Dieses Modell führte Quantenkonzepte bei der Beschreibung elektronischer Umlaufbahnen ein.
Didaktisches Gleichnis zum Verständnis der Dimensionen
 Um die Proportionen des Kerns im Verhältnis zum Rest des Atoms zu verstehen, stellen Sie sich ein riesiges Fußballstadion wie das Camp Nou vor, das völlig leer ist.
Um die Proportionen des Kerns im Verhältnis zum Rest des Atoms zu verstehen, stellen Sie sich ein riesiges Fußballstadion wie das Camp Nou vor, das völlig leer ist.
In der Mitte des Stadions platzieren wir eine kleine Murmel. Diese winzige Kugel stellt den Atomkern dar, den zentralen Teil des Atoms, in dem fast seine gesamte Masse konzentriert ist. Obwohl es im Vergleich zur Gesamtgröße des Stadions unglaublich klein ist, ist es das wichtigste Teil, da es die Protonen und Neutronen enthält, die die Eigenschaften des Atoms bestimmen.
Der Rest des Stadions, dieser riesige leere Raum, symbolisiert den Bereich, in dem sich die Elektronen bewegen. Elektronen sind winzige negativ geladene Teilchen, die um den Kern kreisen wie Bienen, die um eine Blume schweben. Obwohl sie viel Platz beanspruchen, wiegen sie so wenig, dass ihre Masse kaum zum Gesamtatom beiträgt.