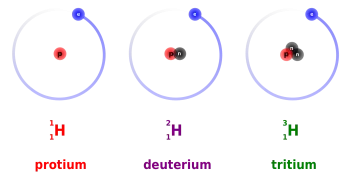
Tritium und Deuterium sind zwei der drei Wasserstoffisotope, die als Brennstoff in Kernfusionsreaktionen verwendet werden. Wasserstoff hat drei Isotope: Protium, Deuterium und Tritium.
Eine Kernfusionsreaktion besteht aus der Vereinigung zweier leichter Kerne (Wasserstoffatome) zu einem einzigen. Dies tritt auf, wenn Kerne so nahe beieinander liegen, dass die Kernkräfte zwischen ihnen sehr stark werden.
Diese Energieart befindet sich in der Studienphase und soll als elektrische Energiequelle eine Alternative zu den derzeitigen Kernspaltungsreaktoren darstellen. Der Vorteil dieser Technologie liegt in der praktisch unbegrenzten Energiegewinnung, da Deuterium und Tritium aus gewöhnlichem Wasserstoff gewonnen werden können. Es sollte daran erinnert werden, dass dieses chemische Element in der Luft und im Meerwasser reichlich vorhanden ist.
Was ist Tritium?
Tritium ist ein radioaktives Wasserstoffisotop, dessen Kern aus einem Proton und zwei Neutronen besteht. Die wichtigste Anwendung von Tritium ist die Verwendung als Kernbrennstoff zur Energiegewinnung durch Kernfusion.
Es wird normalerweise mit dem Symbol T bezeichnet, obwohl es systematisch als 3H symbolisiert werden sollte. Es wurde 1934 von Rutherford, Oliphant und Harteck bei der Untersuchung des Beschusses von Deuterium mit Deuteronen entdeckt.
Tritium ist ein natürliches Isotop, das durch die Einwirkung kosmischer Strahlung auf atmosphärische Gase entsteht. Andererseits kann dieses Isotop industriell durch Beschuss von Lithium mit niederenergetischen Neutronen gewonnen werden.
Tritium hat eine Halbwertszeit von 12,3 Jahren und emittiert sehr energiearme Beta (β)-Strahlung (0,018 MeV), völlig frei von γ-Strahlung, so dass es praktisch keine Radiotoxizität aufweist.
Gesundheitliche Auswirkungen von Tritium
Beta-Partikel, die durch die Zersetzungsreaktion von Tritium gebildet werden, breiten sich in der Luft nur 6,0 mm aus und können nicht einmal die oberste Schicht der menschlichen Haut überwinden. Dieses Isotop stellt jedoch eine Strahlengefahr dar, wenn es eingeatmet, mit der Nahrung aufgenommen und durch die Haut aufgenommen wird.
Wofür wird Tritium verwendet?
Tritium kann in verschiedenen Anwendungen mit unterschiedlichen Zielsetzungen eingesetzt werden:
-
Energieautarke Beleuchtung: Beta-Partikel, die beim radioaktiven Zerfall kleiner Mengen Tritium emittiert werden, bringen Chemikalien namens Phosphor zum Leuchten.
-
Atomwaffen: Dieses chemische Element wird verwendet, um die Effizienz und Leistung von Kernspaltungsbomben und die Spaltungsstufen von Wasserstoffbomben in einem als Boosting bekannten Prozess zu verbessern.
-
Kontrollierte Kernfusion: Tritium ist ein wichtiger Brennstoff für die kontrollierte Kernfusion in Kernreaktoren mit magnetischem Einschluss und Trägheitsfusion.
-
Analytische Chemie: Tritium wird manchmal als Radiomarker verwendet. Es hat den Vorteil, dass fast alle organischen Chemikalien Wasserstoff enthalten, sodass es einfach ist, einen Platz zu finden, um Tritium in das zu untersuchende Molekül einzubringen.
Was ist Deuterium?
Deuterium (²H) ist ein stabiles Wasserstoffisotop, das in der Natur mit einem Verhältnis von einem zu 6500 Wasserstoffatomen vorkommt. Der Atomkern von Deuterium besteht aus einem Proton und einem Neutron.
Deuterium ist auch als schwerer Wasserstoff bekannt und wird durch das Symbol ²H oder als D dargestellt. Obwohl es ein Wasserstoffatom ist, sind die physikalischen Eigenschaften zwischen Deuterium und einem leichten Wasserstoffatom maximal, da die Atommasse von Deuterium doppelt so groß ist.
Die Erde und andere Teile des Sonnensystems enthalten Deuterium. Die Sternfusion zerstört Deuterium, und es gibt keine bekannten natürlichen Entstehungsprozesse außer der primordialen Nukleosynthese.
Wofür wird Deuterium verwendet?
Deuterium ist aufgrund des großen Reaktionsquerschnitts zusammen mit Tritium in Kernfusionsprozessen nützlich.
In der Chemie und Biochemie wird Deuterium als nicht radioaktiver Isotopen-Tracer in Molekülen verwendet, um chemische Reaktionen und Stoffwechselveränderungen zu untersuchen, da es sich chemisch ähnlich wie gewöhnlicher Wasserstoff verhält. Wir können ihn jedoch durch seine Masse von gewöhnlichem Wasserstoff unterscheiden.