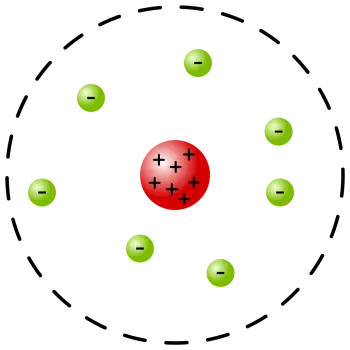
Rutherfords Atommodell oder Planetenmodell des Atoms ist ein von Ernest Rutherford vorgeschlagenes Modell.
1909 wurde das Geiger- und Marsden-Experiment durchgeführt, auch bekannt als Rutherford-Experiment, da es von Rutherford selbst geleitet wurde. Die bei der Untersuchung beobachtete Rutherford-Streuung deutete darauf hin, dass die frühen Atommodelle "Panettone" und "Saturnian" falsch waren.
Das von Rutherford vorgeschlagene neue Modell hatte Eigenschaften, die auch in späteren Modellen beibehalten wurden, wie zum Beispiel:
-
Die Konzentration der meisten Materie in einem kleinen Volumen im Vergleich zur Atomgröße, d. h. eines Atomkerns
-
Das Vorhandensein von Elektronen, die sich um den Atomkern drehen.
Rutherford sagte nichts über die mögliche Bewegung der Elektronen, weil er wusste, dass ihre Rotation um den Zentralkern elektromagnetische Strahlungen verursachen würde. Strahlung kann nur auftreten, wenn das Elektron von einer Bahn in eine andere springt.
Als Re das Atom mit einem Kern und umkreisenden Elektronen zeigte, wie die Planeten des Sonnensystems, wurde es als Planetenmodell bekannt.
Was sind die Postulate des Rutherford-Modells?
-
Das Atom ist meist leerer Raum. Rutherford bestritt das Atommodell von Thomson, indem er die Existenz des bereits von Nagaoka postulierten Atomkerns bestätigte. Rutherford wies jedoch darauf hin, dass der Atomkern im Vergleich zum Atom selbst winzig ist.
-
Der Atomkern konzentriert die Masse und die positiven Ladungen des Atoms und gleicht die elektrische Ladung der Elektronen aus.
-
Die um das Atom herum vorhandenen negativ geladenen Elektronen beeinflussen die Streuung der Alphateilchen nicht.
Wie hat Bohr Rutherfords Atommodell erweitert?
Niels Bohr hat die Linienspektren der Elemente in Beziehung gesetzt. Er benutzte ein Wasserstoffatom . Also schlug Bohr 1913 einige Postulate vor, die die Ansicht von Rutherfords Atommodell veränderten. Er zeigte, dass sich Elektronen auf Kreisbahnen mit wohldefinierter Energie (quantenmechanischer Energie) um den Atomkern bewegen, also ein Energieniveau oder eine elektronische Schicht darstellen. Für jedes Elektron sind nur bestimmte Energiemengen zulässig, mit mehreren ganzzahligen Werten des Photons (Quantenzahl).
Er zeigte auch, dass sich das Atom im Grundzustand befindet, der am stabilsten ist, wenn alle Elektronen in den Atomen auf ihren niedrigsten Energieniveaus um den Kern kreisen. Wenn das Elektron jedoch Photonen absorbiert, springt es von einem Niveau näher am Kern auf ein höheres, externeres Energieniveau. Es ist der aktivierte Zustand oder angeregte Zustand. Aber es ist instabil, und das Elektron emittiert bald überschüssige Energie und kehrt auf das niedrigere Energieniveau zurück.
Mit der Max-Planck-Konstante erhielt Bohr eine exakte Formel für die Energieniveaus des Wasserstoffatoms. Außerdem postulierte er, dass der Drehimpuls des Elektrons quantisiert ist.
Wie sah das Experiment von Ernest Rutherford aus?
1911 schlug Rutherford sein Modell der Atomstruktur vor, um die Ergebnisse des früheren Experiments von Geiger und Marsden zu erklären, das die Anwesenheit einer Konzentration positiv geladener Teilchen im Zentrum des Atoms anzeigte: dem Atomkern.
In seiner Arbeit schlug Rutherford jedoch vor, ein Hochgeschwindigkeits-α-Teilchen durch ein Atom in einer Goldfolie mit einer positiven Zentralladung zu leiten, während es von einer Elektronenladung gleicher Größe umgeben ist. Rutherford schloss daraus, dass die Ladung relativ zur Atomgröße auf ein minimales Volumen konzentriert werden muss.
Den Bahnen der Elektronen schrieb er keine Struktur zu. Er erwähnte jedoch das Atommodell Hantarō Nagaoka.