Im Jahr 1904 schlug Joseph John Thomson eine Weiterentwicklung von Daltons Atommodell vor und führte so zum berühmten Thomson-Modell, einer revolutionären Theorie, die versuchte, zwei grundlegende Eigenschaften der damaligen Atome zu erklären.
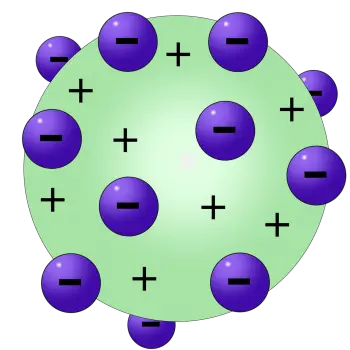
In diesem Modell postulierte Thomson, dass Elektronen, negativ geladene Teilchen, in einem positiv geladenen Hintergrund verteilt seien und eine Struktur erzeugten, die einem britischen Dessert ähnelte, das als „Plum Pudding“ bekannt ist. Dieser seltsame Spitzname kommt von der visuellen Analogie von Elektronen (den „Rosinen“), die auf einem positiven Hintergrund (dem „Pudding“) verstreut sind.
Diese neue Atomtheorie von Thomson versuchte, zwei damals bekannte Eigenschaften von Atomen zu erklären:
- Elektronen sind negativ geladene Teilchen.
- Atome haben keine neutrale elektrische Ladung.
Thomsons Postulate
Das Atommodell von JJ Thomson führte mehrere Schlüsselpostulate ein, die die damals beobachteten Eigenschaften von Atomen erklären sollten. Hier sind die grundlegenden Postulate und ihre Eigenschaften:
- Elektronen als subatomare Teilchen: Thomson postulierte die Existenz negativ geladener subatomarer Teilchen, die später als Elektronen identifiziert wurden. Dies war ein wichtiger Fortschritt, da Atome bis dahin nach Daltons Atommodell als unteilbar galten.
- Kugelstruktur des Atoms: Thomson stellte sich das Atom als eine gleichmäßige, positiv geladene Kugel vor, in der die negativ geladenen Elektronen wie Rosinen in einem Pudding eingebettet waren. Dieses Konzept der Kugelstruktur stand im Gegensatz zu Daltons früherer Vorstellung von unteilbaren Atomen.
- Gleichmäßige Verteilung der Elektronen: Nach Thomsons Modell waren die Elektronen gleichmäßig in der positiv geladenen Kugel verteilt. Mit dieser Anordnung sollte die elektrische Neutralität des Atoms als Ganzes erklärt werden.
- Freie Bewegung der Elektronen: Nach diesem Postulat galten Elektronen als fähig, sich innerhalb der positiv geladenen Kugel frei zu bewegen, was die Stabilität des Atoms erklärte. Thomson vermutete, dass Anziehungskräfte zwischen den Elektronen und der umgebenden positiven Ladung dafür verantwortlich seien, die Elektronen auf ihren Bahnen zu halten.
- Erklärung der Linienspektren: Thomson schlug vor, dass sich Elektronen frei in ringförmigen Bahnen innerhalb des Atoms drehen. Unterschiede in den Energien dieser Orbitalniveaus würden die Linienspektren erklären, die in der Lichtemission beobachtet werden, wenn Elektronen zwischen diesen Orbits springen.
Warum ist es als Plumpudding-Modell bekannt?
 Thomsons Modell wurde häufig mit dem britischen Dessert Plum Pudding verglichen, was ihm seinen charakteristischen Namen einbrachte. Obwohl Thomson es nicht so beschrieb, wurde die Analogie von anderen übernommen, um seine Idee besser zu veranschaulichen.
Thomsons Modell wurde häufig mit dem britischen Dessert Plum Pudding verglichen, was ihm seinen charakteristischen Namen einbrachte. Obwohl Thomson es nicht so beschrieb, wurde die Analogie von anderen übernommen, um seine Idee besser zu veranschaulichen.
In diesem Modell sind negativ geladene Elektronen so verteilt, als wären sie „Rosinen“, eingebettet in eine positiv geladene Masse, die den „Pudding“ darstellt. Auf diese Weise gleicht die positive Ladung die negative Ladung der Elektronen aus und hält das Atom als Ganzes elektrisch neutral. Obwohl diese einfache Darstellung inzwischen veraltet ist, half sie zu veranschaulichen, wie subatomare Teilchen auf relativ kleinem Raum koexistieren konnten, bevor genauere Details über die Struktur des Atoms bekannt waren.
Merkmale des Atommodells von Thomson
Nach dem Atommodell von Thomson besteht das Atom aus Elektronen, die in einer positiv geladenen „Suppe“ untergebracht sind, die die elektrisch negativen Ladungen der Elektronen ausgleicht.
Nach diesem Modell könnten Elektronen in einem Tropfen oder einer Wolke einer solchen positiv geladenen Substanz frei rotieren. Ihre Umlaufbahnen wurden innerhalb des Atoms dadurch stabilisiert, dass, wenn sich ein Elektron vom Zentrum einer positiv geladenen Wolke entfernt, die Anziehungskraft zum Zentrum der Wolke hin zunimmt.
Diese Anziehungskraft bringt es zurück in die Mitte. Die Anziehungskraft auf das Zentrum einer gleichmäßig geladenen kugelförmigen Wolke ist direkt proportional zum Abstand zu ihrem Zentrum.
In Thomsons Modell können sich Elektronen frei in Ringbahnen drehen, die durch Wechselwirkungen zwischen Elektronen stabilisiert werden. Die Linienspektren wurden durch den Energieunterschied bei der Bewegung entlang verschiedener Ringbahnen erklärt.
Thomsons Modell wurde zum Vorläufer des späteren Bohr-Atommodells, das das Atom als Abbild des Sonnensystems darstellt .
Modellbeschränkungen
Thomsons Atommodell wurde 1909 in einem Experiment zur Streuung von Alphateilchen in Goldfolie widerlegt, das 1911 von Ernest Rutherford analysiert wurde. Rutherfords Experiment legte nahe, dass das Atom einen sehr kleinen Kern mit einer großen positiven Ladung hatte.
Im Jahr 1913 wies Henry Moseley experimentell nach, dass die Kernladung in Elementarladungen sehr nahe an der Ordnungszahl liegt.
Diese Arbeit führte schließlich im selben Jahr zur Schaffung des Bohr-Modells, ähnlich dem Sonnensystem. Nach diesem Modell hat der Kern eine positive Ladung gleich der Ordnungszahl und ist von einer gleichen Anzahl Elektronen in Orbitalschalen umgeben.
Thomsons Problem
Durch die Betrachtung von Thomsons Modell wurde ein noch ungelöstes Problem der mathematischen Physik formuliert – die Suche nach der Konfiguration vieler Ladungen mit der niedrigsten potentiellen Energie auf einer Kugel – das Thomson-Problem.
Thomson Legacy
JJ Thomsons Vermächtnis in Physik und Chemie ist unbestreitbar, nicht nur durch die Entdeckung des Elektrons, sondern auch durch die Revolutionierung unserer Denkweise über Atome. Obwohl das „Plum Pudding“-Modell schließlich abgelöst wurde, stellte es einen entscheidenden Schritt hin zu einem modernen Verständnis des Themas dar. Thomson stellte mit seinen Postulaten die Vorstellung in Frage, dass Atome unteilbar seien, und öffnete die Türen zu einer Ära der subatomaren Forschung.
Meiner Meinung nach ist das Bewundernswerteste an Thomsons Arbeit seine Fähigkeit, über akzeptierte Ideen hinauszuschauen und etwas völlig Neues vorzuschlagen, was bemerkenswerten intellektuellen Mut erfordert. Obwohl sein Modell im Vergleich zu späteren Fortschritten einfach war, war es entscheidend für die Entwicklung der modernen Physik. Es ist eine Erinnerung daran, dass jede Theorie, selbst wenn sie im Laufe der Zeit verfeinert oder verworfen wird, der Funke sein kann, der den nächsten großen wissenschaftlichen Durchbruch vorantreibt.
In diesem Sinne liegt Thomsons Vermächtnis nicht nur in seinem Atommodell, sondern auch in seiner Fähigkeit, Bewährtes in Frage zu stellen und eine neue Denkweise über die Natur der Materie zu fördern. Ohne seine Arbeit wäre das heutige Verständnis des Atoms nicht möglich gewesen.