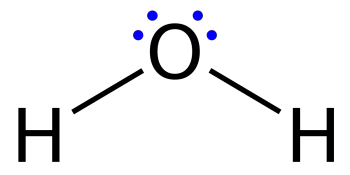
Lewis-Strukturen, auch Punktdiagramme oder Lewis-Modelle genannt, sind Diagramme, die die Bindung zwischen den Atomen eines Moleküls zusammen mit den vorhandenen Elektronenpaaren darstellen. Für jedes kovalent verknüpfte Molekül sowie für Koordinationsverbindungen kann eine Lewis-Struktur erstellt werden.
Lewis-Strukturen sind nach Gilbert Newton Lewis benannt , der sie 1916 einführte.
Diagramme zur Darstellung einer gepunkteten Elektronenkonfiguration, bei der Valenzelektronen in freien Elektronenpaaren durch Punkte dargestellt werden, sind ähnlich, können aber auch Linien enthalten, die gemeinsame Paare in einer chemischen Bindung (Einzel-, Doppel-, Dreifachbindung usw.) darstellen.
Zwischen gebundenen Atomen werden Linien gezeichnet (es können auch Punktpaare verwendet werden). Überschüssige Elektronen, die freie Elektronenpaare bilden, werden durch Punktpaare neben den Atomen dargestellt.
Wofür wird die Lewis-Struktur verwendet?
Eine Lewis-Struktur ist eine grafische Darstellung, die die Molekülgeometrie einer Verbindung, die Bindungen, die sich zwischen Molekülen bilden, und den Abstand zwischen ihnen zeigt. Das heißt, diese Strukturen zeigen jedes Atom und seine Position in der Struktur des Moleküls anhand seines chemischen Symbols.
Lewis-Modelle dienen dazu, die Anzahl der Valenzelektronen eines Elements darzustellen, das mit anderen chemischen Elementen derselben oder einer anderen Spezies unter Bildung von Bindungen wechselwirkt.
Wie wird ein Lewis-Punktdiagramm erstellt?
Um die Lewis-Struktur eines Moleküls darzustellen, muss man ein Zentralatom darstellen. Die anderen Elemente, aus denen das Molekül besteht, werden rund um das Zentralatom dargestellt.
Das Zentralatom sollte möglichst das am wenigsten elektronegative sein, zum Beispiel Kohlenstoff. Andererseits wird Wasserstoff immer als Endatom dargestellt.
die Oktettregel
Die Oktettregel ist eine Regel, die besagt, dass Atome sich miteinander verbinden, um ihre letzte Schicht elektronischer Konfiguration zu vervollständigen.
Diese Regel besagt, dass stabile Atome acht Elektronen in ihrer Valenzschale haben.
Um diese Stabilität zu erreichen, muss jedes Atom in den von ihm gebildeten chemischen Bindungen Elektronen teilen, verlieren oder gewinnen, bis es über die erforderlichen acht Elektronen in der Valenzschale verfügt.
Durch das Zeichnen eines Diagramms vermeiden wir, jedem Element mehr als acht Elektronen zuzuordnen, da jede einzelne kovalente Bindung jedem Atom in der Bindung zwei Elektronen beisteuert.
Valenzelektronen
Die im Lewis-Modell dargestellte Gesamtzahl der Elektronen entspricht der Summe der Anzahl der Valenzelektronen in jedem einzelnen Atom. Im Gegensatz dazu sind einzelne Nichtvalenzelektronen nicht vertreten.
Die in der Lewis-Struktur dargestellte Valenz ist die Anzahl der Elektronen im letzten Energieniveau jedes chemischen Elements bei der Bildung seiner elektronischen Konfiguration.
Nachdem die Valenzelektronen bestimmt wurden, müssen diese im Diagramm lokalisiert werden. Wenn dann alle freien Elektronenpaare platziert sind, gehorchen die Atome möglicherweise nicht der Oktettregel.
Alle Atome in einem Diagramm müssen gebunden sein. In einer Lewis-Struktur gehen wir davon aus, dass ein Elektronenpaar eine Bindung zwischen zwei Atomen bildet. So wie wir davon ausgehen, dass zwei Atome dasselbe Bindungspaar haben, hat das Atom, das ursprünglich das freie Elektronenpaar hatte, immer noch ein Oktett.