Die Molmasse ist eine physikalische Eigenschaft, die zur Beschreibung der durchschnittlichen Masse eines Atoms oder Moleküls einer Substanz in der Einheit Gramm pro Mol (g/mol) verwendet wird und durch den Buchstaben „M“ dargestellt wird.
Mit anderen Worten: Die Molmasse gibt an, wie viele Gramm einer Substanz in einem Mol dieser Substanz enthalten sind. Das Mol ist eine Mengeneinheit einer Substanz im Internationalen Einheitensystem (SI).
Messeinheiten
Im Internationalen Einheitensystem (SI) ist die Einheit zur Messung der Molmasse Kilogramm pro Mol (kg/mol). Wenn die Molmasse jedoch in g/mol ausgedrückt wird, ist ihr numerischer Wert derselbe wie das relative Molekulargewicht. Aus diesem Grund wird das Molgewicht historisch im Allgemeinen in Gramm pro Mol (g/mol) ausgedrückt.
Die Molmasse wird in Formeln üblicherweise mit einem Großbuchstaben M angegeben.
Mit Methoden der Massenspektrometrie werden direkte Vergleiche und Messungen der Massen von Atomen und Molekülen durchgeführt.
Berechnung der Molmasse
Die Berechnung der Molmasse einer Verbindung erfolgt durch Addition der Massen aller Atome in einem Molekül unter Verwendung der relativen Atommassen.
Relative Atommassen sind Zahlen, die die Masse eines Atoms im Verhältnis zur Masse des Kohlenstoff-12-Atoms darstellen, die als 12 Atommasseneinheiten (amu) definiert ist.
Beispielsweise beträgt die relative Atommasse von Wasserstoff etwa 1 amu, während die relative Atommasse von Sauerstoff etwa 16 amu beträgt.
Komplexe Moleküle
 Um die Anzahl der Molmassen komplexer Moleküle zu berechnen, kann diese durch Addition der Molmassen ihrer Bestandteile bestimmt werden. Beispielsweise beträgt die Molmasse von Wasser H 2 O
Um die Anzahl der Molmassen komplexer Moleküle zu berechnen, kann diese durch Addition der Molmassen ihrer Bestandteile bestimmt werden. Beispielsweise beträgt die Molmasse von Wasser H 2 O
M(H 2 O) = 2 M(H) + M(O) = 2,1 g/mol + 16 g/mol = 18,1 g/mol
Wie berechnet man die Molmasse Schritt für Schritt?
Die Berechnung der Molmasse einer chemischen Substanz kann durch die folgenden Schritte erfolgen:
-
Identifizieren Sie die chemische Formel der chemischen Verbindung.
-
Bestimmen Sie, wie viele Atome jedes Elements in der chemischen Formel enthalten sind.
-
Multiplizieren Sie die Anzahl der Atome jedes Elements mit seiner relativen Atommasse.
-
Addiere die Massen aller Atome in der Formel, um die Molmasse zu erhalten.
Praxisbeispiel
Schauen wir uns ein konkretes Beispiel zur Berechnung der Molmasse von Wasser (H₂O) an:
-
Die chemische Formel von Wasser lautet H₂O, was bedeutet, dass es zwei Wasserstoffatome (H) und ein Sauerstoffatom (O) enthält.
-
Die relative Atommasse von Wasserstoff beträgt etwa 1 amu und die von Sauerstoff etwa 16 amu.
-
Um die Molmasse von Wasser zu berechnen, addieren wir die Massen der Atome: (2 * 1 amu) + (1 * 16 amu) = 2 amu + 16 amu = 18 amu.
Daher beträgt die Molmasse von Wasser 18 g/mol.
Beispiele
Nachfolgend finden Sie eine Tabelle mit Beispielen einiger Molmassen verschiedener Stoffe:
|
Substanz |
Chemische Formel |
Molmasse (g/mol) |
Beschreibung |
|
Wasserstoff |
H₂ |
2 |
Wasserstoff ist mit einer Molmasse von 2 g/mol das leichteste Element. |
|
Sauerstoff |
O₂ |
32 |
Sauerstoff ist für die Atmung unerlässlich und hat eine Molmasse von 32 g/mol. |
|
Kohlendioxid |
CO₂ |
44 |
CO₂ ist ein Treibhausgas mit einer Molmasse von 44 g/mol. |
|
Ammoniak |
NH₃ |
17 |
Ammoniak wird in der chemischen Industrie verwendet und hat eine Molmasse von 17 g/mol. |
|
Methan |
CH₄ |
16 |
Methan ist der Hauptbestandteil von Erdgas und hat eine Molmasse von 16 g/mol. |
|
Schwefelsäure |
H₂SO₄ |
98 |
Schwefelsäure ist eine weit verbreitete starke Säure mit einer Molmasse von 98 g/mol. |
|
Glucose |
C₆H₁₂O₆ |
180 |
Glukose ist ein in Lebensmitteln vorkommender Zucker mit einer Molmasse von 180 g/mol. |
|
Natriumchlorid (Speisesalz) |
NaCl |
58,5 |
Natriumchlorid ist gewöhnliches Speisesalz und hat eine Molmasse von 58,5 g/mol. |
|
Uran |
ODER |
238.03 |
Uran ist ein Element, das als Brennstoff in Kernreaktoren verwendet wird. |
|
Plutonium |
Pu |
244 |
Plutonium ist ein Element, das in Atomwaffen und Kernreaktoren verwendet wird. |
|
Schweres Wasser |
D₂O |
20.03 |
Schweres Wasser enthält Deuterium anstelle von Wasserstoff und wird in Kernreaktoren verwendet. |
|
Angereichertes Uran |
U-235 |
Es variiert |
Angereichertes Uran enthält einen höheren Anteil an U-235 und ist für die Kernspaltung unerlässlich. |
Wofür wird die Molmasse verwendet?
Die Molmasse ist eine grundlegende Eigenschaft, die verschiedene Auswirkungen und Anwendungen in der Chemie und anderen wissenschaftlichen Disziplinen hat.
Zu den bemerkenswertesten Anwendungen gehören:
-
Umrechnung zwischen Mol und Gramm: Wird zur Umrechnung zwischen der Menge einer Substanz in Mol und der Masse einer Substanz in Gramm verwendet.
-
Bestimmung der Stoffzusammensetzung.
-
Berechnung chemischer Reaktionen: Sie ist für die Berechnung der Mengen an Reaktanten und Produkten in einer chemischen Reaktion unerlässlich und ermöglicht die Stöchiometrie und Experimentplanung.
-
Identifizierung unbekannter Substanzen: Wird in Analysetechniken wie der Massenspektroskopie verwendet, um unbekannte Substanzen durch Vergleich ihrer experimentellen Molmassen mit berechneten Molmassen zu identifizieren.
-
Anwendungen in der Thermodynamik: In der chemischen Thermodynamik wird es zur Berechnung von Eigenschaften wie Enthalpie und Entropie chemischer Reaktionen verwendet.
Bedeutung des Alltags
Die Molmasse ist nicht nur im Labor wichtig, sondern findet auch im Alltag Anwendung. Einige Beispiele sind:
-
Ernährung : In der Lebensmittelindustrie wird es zur Berechnung der Nährstoffmenge in Lebensmitteln und zur Festlegung täglicher Verzehrempfehlungen für essentielle Nährstoffe wie Proteine, Kohlenhydrate und Fette verwendet.
-
Pharmakologie : Bei der Arzneimittelformulierung ist es entscheidend, die Molmasse der Wirkstoffe und Hilfsstoffe zu kennen, um die richtige Dosierung und Wirksamkeit des Arzneimittels sicherzustellen.
-
Energie : In der Energiewirtschaft wird die Molmasse bei der Produktion und Nutzung von Kraftstoffen und erneuerbaren Energien verwendet, beispielsweise zur Berechnung der Kraftstoffdichte und des Brennstoffzellenwirkungsgrads.
Beziehung zum Periodensystem
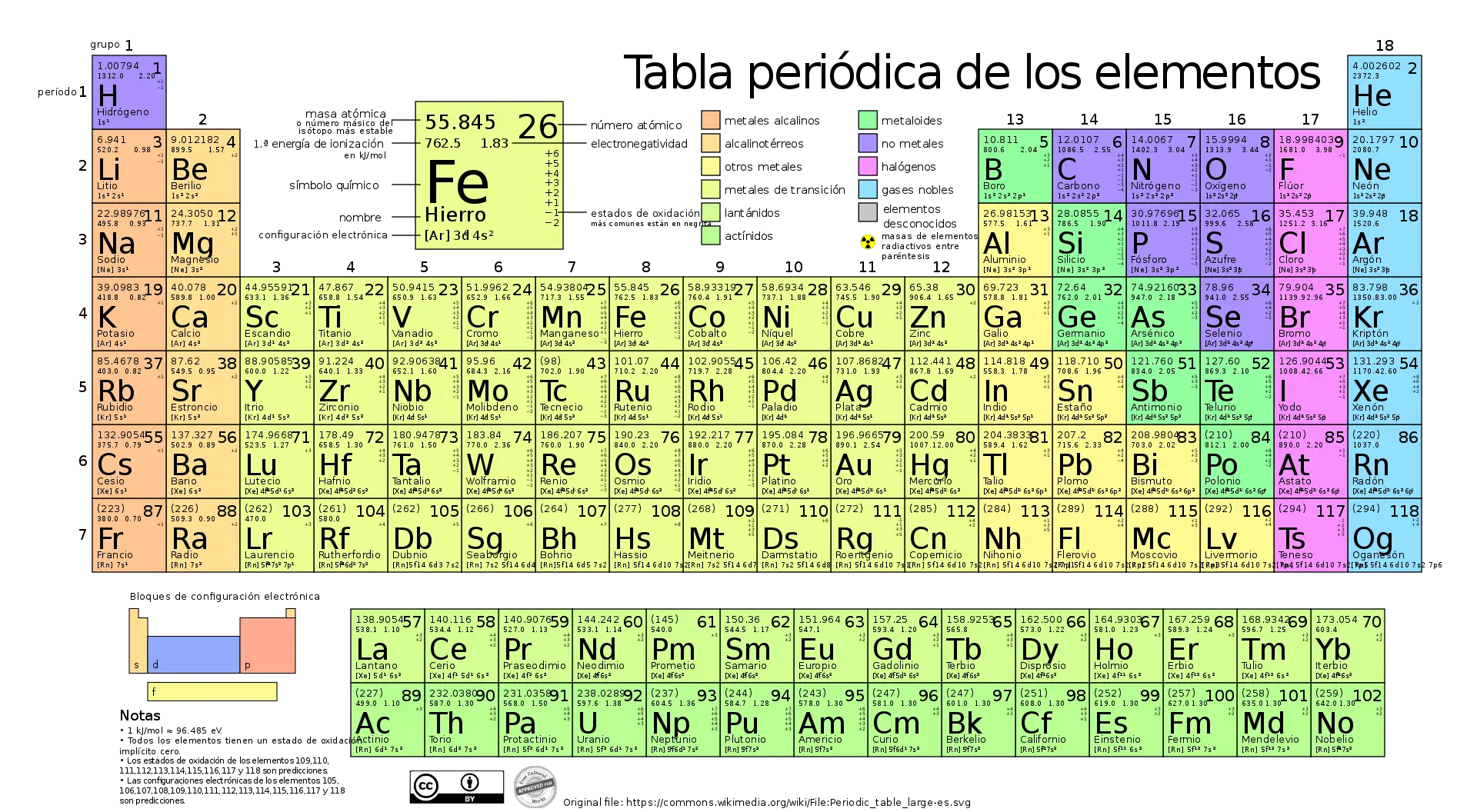 Das Periodensystem der chemischen Elemente ist ein unschätzbares Hilfsmittel zur Bestimmung der Molmassen von Elementen und Verbindungen. Jedes Element im Periodensystem hat eine relative Atommasse, die bei Isotopen auf ganze Zahlen oder einfache Brüche gerundet wird.
Das Periodensystem der chemischen Elemente ist ein unschätzbares Hilfsmittel zur Bestimmung der Molmassen von Elementen und Verbindungen. Jedes Element im Periodensystem hat eine relative Atommasse, die bei Isotopen auf ganze Zahlen oder einfache Brüche gerundet wird.
Um die Molmasse einer Verbindung zu berechnen, addieren Sie einfach die relativen Atommassen der vorhandenen Elemente, multipliziert mit der Anzahl der Atome jedes Elements in der Formel.
Beispiel für Natriumchlorid
Ein interessantes Beispiel ist die Berechnung der Molmasse von Natriumchlorid (NaCl).
Natrium (Na) hat eine relative Atommasse von etwa 23 amu und Chlor (Cl) hat eine relative Atommasse von etwa 35,5 amu.
Daher ist die Molmasse von NaCl die Summe dieser Atommassen: 23 amu + 35,5 amu = 58,5 amu, was 58,5 g/mol entspricht.
Nicht zu verwechseln mit...
Die Molmasse wird oft mit anderen Konzepten in der Chemie und Physik verwechselt, da sie sich alle auf das Gewicht oder die Menge einer Substanz beziehen. Hier sind einige Konzepte, die häufig verwechselt werden mit:
- Molekularmasse : Die Molekularmasse ist die Summe der Atommassen der Atome in einem Molekül, dasselbe wie die Molmasse, jedoch ausgedrückt in Atommasseneinheiten (uma oder ou) , nicht in g/mol. Molmasse und Molekülmasse haben den gleichen numerischen Wert, unterscheiden sich jedoch in ihren Einheiten und dem Kontext, in dem sie verwendet werden.
- Atommasse : Dies ist die durchschnittliche Masse der Atome eines Elements unter Berücksichtigung der Häufigkeit seiner Isotope und wird in Atommasseneinheiten (u) gemessen. Die Atommasse wird verwendet, um die Molmasse eines Elements im Zusammenhang mit einer Substanz zu berechnen.
- Molekulargewicht : Dieser Begriff wurde früher als Synonym für Molekülmasse verwendet, ist jedoch nicht korrekt. Gewicht ist eine Kraft (das Ergebnis der auf eine Masse einwirkenden Schwerkraft) und wird in Newton (N) gemessen, während die Molekularmasse ein Maß für die Menge an Materie in atomaren Masseneinheiten ist. Es ist richtiger, von Molekularmasse als von Molekulargewicht zu sprechen.
- Stoffmenge (Mol) : Wird manchmal mit der Molmasse verwechselt, da beide Konzepte das Mol betreffen. Allerdings ist die Stoffmenge (Mol) ein Maß für die Anzahl der Teilchen (Atome, Moleküle, Ionen) in einer Probe und nicht für deren Masse. Die Molmasse hingegen gibt die Masse eines Mols dieser Teilchen an.
- Molvolumen : Dieses Konzept bezieht sich auf das Volumen, das von einem Mol einer Substanz eingenommen wird, insbesondere im Zusammenhang mit Gasen, und wird normalerweise in L/mol ausgedrückt. Sie unterscheidet sich von der Molmasse, die die Massemenge in Gramm pro Mol Substanz misst.