Chemie ist eine Wissenschaft, die auf der Organisation chemischer Elemente im Periodensystem basiert und ein wesentliches Werkzeug zum Verständnis und zur Vorhersage des Verhaltens von Atomen und Molekülen ist.
Im Laufe der Geschichte haben mehrere Wissenschaftler zur Entwicklung des Periodensystems beigetragen, und einer der ersten Versuche, die Elemente zu ordnen, war das Gesetz der Oktaven.
Historische Ursprünge
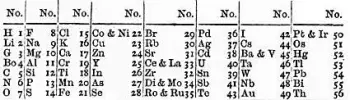
 Das Oktavgesetz ist ein Konzept, das Mitte des 19. Jahrhunderts entstand, als der britische Chemiker John Newlands einen Trend bei den chemischen Eigenschaften von Elementen bemerkte.
Das Oktavgesetz ist ein Konzept, das Mitte des 19. Jahrhunderts entstand, als der britische Chemiker John Newlands einen Trend bei den chemischen Eigenschaften von Elementen bemerkte.
Im Jahr 1864 stellte Newlands seine Idee in einem Artikel mit dem Titel „Über das Gesetz der Oktaven“ vor. In dieser Arbeit beobachtete Newlands, dass sich die chemischen Eigenschaften alle acht Elemente zu wiederholen scheinen, wenn Elemente in der Reihenfolge ihrer zunehmenden Atommassen angeordnet werden.
Diese Wiederholung ähnelt der Wiederholung von Musiknoten in einer musikalischen Oktave, daher der Name „Gesetz der Oktaven“.
Einschränkungen des Oktavgesetzes
Obwohl das Oktavgesetz einen wichtigen Schritt zur Organisation der Elemente darstellte, hatte es erhebliche Einschränkungen.
Die größte Einschränkung bestand darin, dass es nur für einige der damals bekannten Elemente funktionierte. Mit anderen Worten: Das Gesetz wurde nicht einheitlich auf alle Elemente angewendet. Newlands konnte sein Gesetz nur auf die ersten 56 Elemente des Periodensystems anwenden, und danach war die Wiederholung chemischer Eigenschaften nicht mehr erkennbar.
Darüber hinaus machte Newlands auch Fehler bei der Organisation einiger Elemente. Beispielsweise platzierte er Eisen und Kobalt in derselben Säule, obwohl sich ihre chemischen Eigenschaften deutlich unterscheiden.
Mendelejews Periodensystem: Überwindung des Oktavgesetzes
Trotz seiner Einschränkungen legte das Gesetz der Oktaven den Grundstein für die spätere Schaffung des modernen Periodensystems. Der russische Chemiker Dmitri Mendelejew, ein Zeitgenosse Newlands, arbeitete an einer ähnlichen Organisation der Elemente und entwickelte 1869 seine eigene Version des Periodensystems.
Mendeleevs wichtigster Beitrag bestand darin, zu erkennen, dass die Organisation der Elemente auf ihren Atommassen basieren musste, aber auch ihre chemischen Eigenschaften und die Periodizität dieser Eigenschaften berücksichtigen musste.
Organisation des Mendelejew-Tisches
Mendelejew ordnete die Elemente nach ihrer zunehmenden Atommasse, hinterließ jedoch Leerstellen im Periodensystem, wo sich seiner Meinung nach damals unbekannte Elemente befinden sollten.
Überraschend war, dass die chemischen Eigenschaften der unbekannten Elemente perfekt zu Mendelejews Vorhersagen passten, als sie später entdeckt wurden.
Osoleszenz des Oktavgesetzes
Der Erfolg von Mendeleevs Periodensystem und seine Fähigkeit, die Eigenschaften noch unentdeckter Elemente vorherzusagen, machten Newlands‘ Oktavgesetz überflüssig und wurden als unzureichend angesehen, um die Organisation der Elemente zu erklären.
Das moderne Periodensystem und die Organisation der Elemente
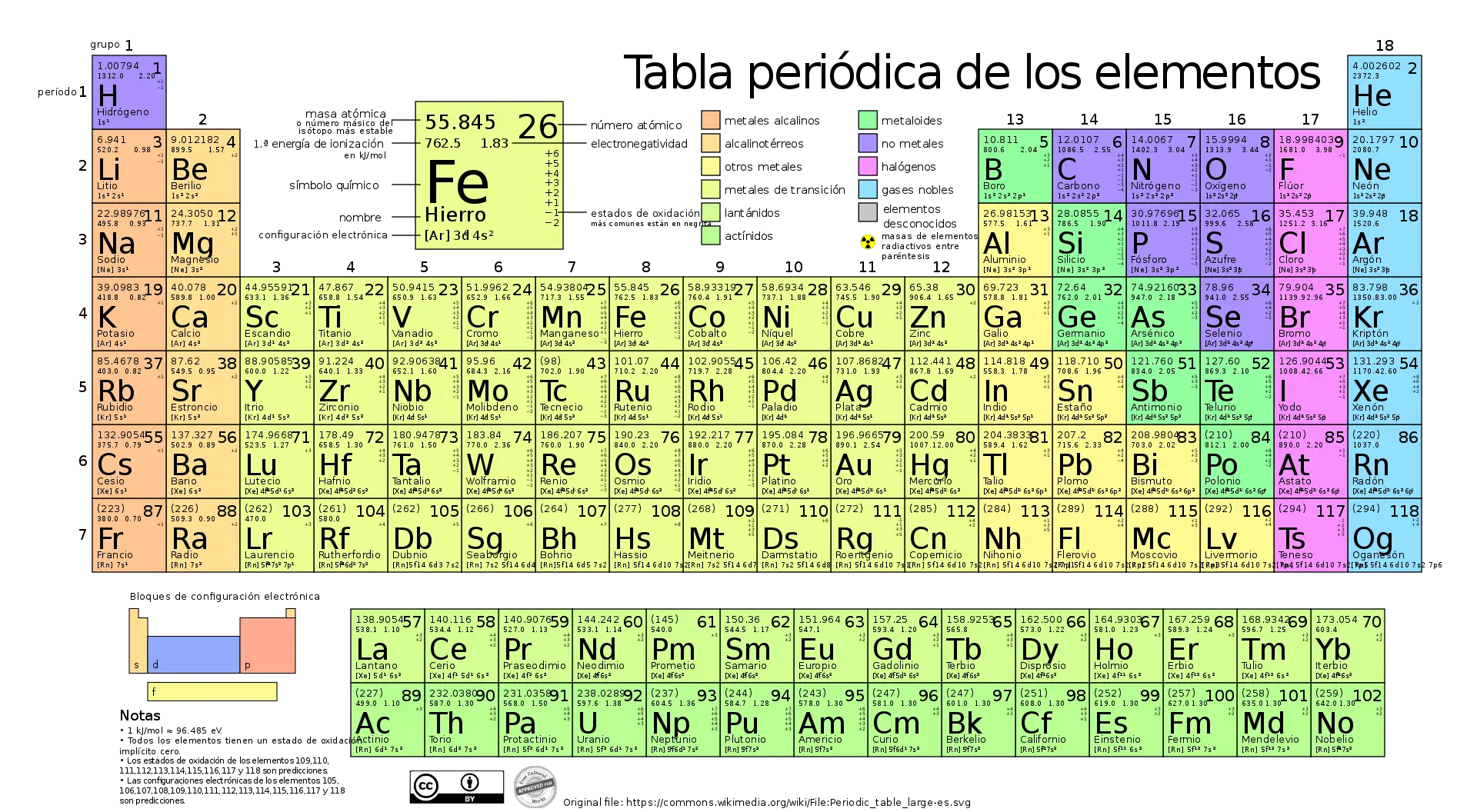 Das moderne Periodensystem basiert auf der von Mendelejew vorgeschlagenen Struktur und Organisation, hat sich jedoch im Laufe der Zeit weiterentwickelt, da immer mehr Elemente entdeckt wurden und Fortschritte beim Verständnis der Atomstruktur und der chemischen Eigenschaften erzielt wurden.
Das moderne Periodensystem basiert auf der von Mendelejew vorgeschlagenen Struktur und Organisation, hat sich jedoch im Laufe der Zeit weiterentwickelt, da immer mehr Elemente entdeckt wurden und Fortschritte beim Verständnis der Atomstruktur und der chemischen Eigenschaften erzielt wurden.
Im heutigen Periodensystem werden die Elemente nach ihrer Ordnungszahl geordnet, also der Anzahl der Protonen im Atomkern. Dadurch entsteht eine Organisation, die die Periodizität der chemischen Eigenschaften der Elemente deutlich zeigt.
Die horizontalen Reihen, Perioden genannt, stellen Energieniveaus dar, in denen sich Elektronen befinden, und die vertikalen Spalten, Gruppen genannt, enthalten Elemente mit ähnlichen chemischen Eigenschaften aufgrund ihrer ähnlichen elektronischen Konfiguration.
Schlussfolgerungen
Das Oktavgesetz war ein früher und wertvoller Versuch, die chemischen Elemente zu ordnen, hatte jedoch erhebliche Einschränkungen und konnte die Organisation aller Elemente nicht ausreichend erklären.
Es war Mendelejews Periodensystem, das diese Einschränkungen schließlich überwand und zu dem wesentlichen Werkzeug wurde, das wir heute kennen.
Die Organisation der Elemente im modernen Periodensystem basiert auf der Ordnungszahl und spiegelt genau die Periodizität der chemischen Eigenschaften der Elemente wider, was maßgeblich zur Weiterentwicklung der Chemie und zum Verständnis der Materie auf atomarer Ebene beigetragen hat.
Zusammenfassend war das Oktavgesetz ein wichtiger Schritt auf diesem Weg, aber es war nur der Anfang eines fortlaufenden Entdeckungs- und Organisationsprozesses in der Chemie.