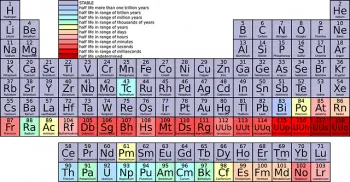
Das Periodensystem der chemischen Elemente ist eines der mächtigsten und wichtigsten Werkzeuge in der Chemie und Wissenschaft im Allgemeinen. Zu seinen markantesten Merkmalen zählen „Familien“ oder „Gruppen“, in denen chemische Elemente entsprechend ihrer ähnlichen Eigenschaften organisiert sind.
Bevor wir uns mit den einzelnen Familien des Periodensystems befassen, ist es wichtig, seine allgemeine Organisation zu verstehen:
Welche Familien gibt es im Periodensystem?
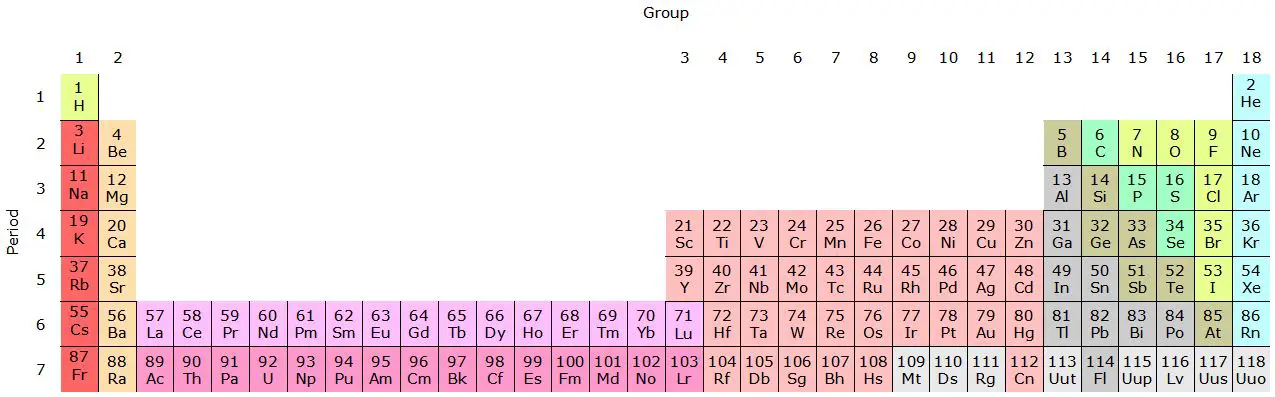 Familien im Periodensystem sind vertikale Gruppen von Elementen mit ähnlichen chemischen Eigenschaften aufgrund ihrer gemeinsamen elektronischen Konfiguration in der äußersten Elektronenhülle.
Familien im Periodensystem sind vertikale Gruppen von Elementen mit ähnlichen chemischen Eigenschaften aufgrund ihrer gemeinsamen elektronischen Konfiguration in der äußersten Elektronenhülle.
Das Periodensystem ist in horizontale Zeilen, die „Perioden“ genannt werden, und vertikale Spalten, die „Gruppen“ oder „Familien“ genannt werden, unterteilt. Die Elemente sind in aufsteigender Reihenfolge der Ordnungszahl angeordnet, also der Anzahl der Protonen im Atomkern.
Die Elemente jeder Familie weisen ähnliche Eigenschaften und chemische Eigenschaften auf. Jede Familie hat eine bestimmte Nummer und wird mit einer römischen Zahl oder einer Ordnungszahl identifiziert (z. B. Gruppe I oder Gruppe 1).
Warum sind Elemente in Familien organisiert?
In den 1860er Jahren versuchte Dmitri Mendelejew, die bekannten Elemente anhand ihrer Eigenschaften und Atommassen zu ordnen.
Während dieses Prozesses bemerkte er, dass, wenn Elemente in aufsteigender Reihenfolge ihrer Atommassen in Reihen angeordnet wurden, sich wiederholende Muster chemischer Eigenschaften erzeugten, die jeder bestimmten Anzahl von Elementen ähnelten.
Dies führte ihn zu der Idee, dass Elemente in Spalten oder Familien organisiert werden sollten, wobei Elemente in derselben Spalte ähnliche chemische Eigenschaften hätten.
Die wichtigsten Familien des Periodensystems
Familie 1: Alkalimetalle
 Alkalimetalle sind die Elemente der Gruppe 1 des Periodensystems, zu der Wasserstoff (H), Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs) und Francium (Fr) gehören.
Alkalimetalle sind die Elemente der Gruppe 1 des Periodensystems, zu der Wasserstoff (H), Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs) und Francium (Fr) gehören.
Grundeigenschaften
Diese Elemente sind hochreaktiv und neigen dazu, ein Elektron abzugeben und positive Ionen zu bilden. Sie sind für ihre Fähigkeit bekannt, heftig mit Wasser zu reagieren und Wasserstoffgas zu erzeugen.
Verwendung und Anwendungen
Alkalimetalle finden in verschiedenen Bereichen Anwendung, von Lithium-Ionen-Batterien in elektronischen Geräten bis hin zur Glasherstellung und der Synthese chemischer Verbindungen.
Familie 2: Erdalkalimetalle
Die Familie der Erdalkalimetalle umfasst die Elemente der Gruppe 2 des Periodensystems, zu der Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radius (Ra) gehören.
Grundeigenschaften
Diese Elemente sind ebenfalls Metalle, jedoch weniger reaktiv als Alkalimetalle. Sie haben zwei Elektronen in ihrer äußersten Schale und neigen dazu, diese beiden Elektronen bei chemischen Reaktionen zu verlieren.
Verwendung und Anwendungen
Erdalkalimetalle sind wichtig für den Aufbau von Knochen und Zähnen (Kalzium), die Herstellung von Metalllegierungen (Magnesium) und die Kerntechnik (Radium).
Familie 17: Halogene
 Halogene bilden die Familie 17 des Periodensystems und umfassen Fluor (F), Chlor (Cl), Brom (Br), Jod (I) und Astat (At).
Halogene bilden die Familie 17 des Periodensystems und umfassen Fluor (F), Chlor (Cl), Brom (Br), Jod (I) und Astat (At).
Grundeigenschaften
Diese Elemente sind hochreaktiv und neigen dazu, ein Elektron aufzunehmen und so negative Ionen zu bilden. Sie sind für ihre Fähigkeit bekannt, mit Alkali- und Erdalkalimetallen ionische Verbindungen zu bilden.
Verwendung und Anwendungen
Halogene finden Anwendung in der Wasserdesinfektion (Chlor), der pharmazeutischen Herstellung (Jod) und der Fotografie (Silberbromid).
Familie 18: Edelgase
Zur Familie der Edelgase, auch Inertgase genannt, gehören Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) und Radon (Rn).
Grundeigenschaften
Diese Elemente sind für ihre geringe chemische Reaktivität bekannt, da sie eine vollständig gefüllte Elektronenhülle haben.
Verwendung und Anwendungen
Diese Stabilität macht Edelgase für Anwendungen wie Neonlampen, kryogene Kühlung und Signallichter nützlich.
Lanthaniden- und Aktinidenfamilie
Am Ende des Periodensystems finden wir zwei Reihen von Elementen, die als Lanthaniden und Aktiniden bekannt sind. Lanthaniden sind F-Block-Elemente, während Aktiniden F-Block-Elemente sind.
Die Lanthaniden und Aktiniden sind zwei Reihen von Elementen, die am Ende des Periodensystems stehen und oft von der typischen Gruppen- oder Familiennummerierung des Hauptsystems ausgeschlossen sind. Diese Reihen werden als „interne Reihen“ oder „f-Reihen“ bezeichnet. Diese Reihe von Elementen wird aufgrund ihrer relativen Seltenheit in der Erdkruste oft als „Seltene Erden“ bezeichnet.
Obwohl Lanthaniden und Aktiniden traditionell nicht als Gruppen im Periodensystem nummeriert werden, werden ihnen manchmal römische Ziffern zugewiesen oder als „Gruppe 3“ für die Lanthaniden und „Gruppe 4“ für die Aktiniden bezeichnet, um sie vereinfacht zu bezeichnen.
Verwendung und Anwendungen
Lanthanide werden bei der Herstellung leistungsstarker Magnete, chemischer Katalysatoren und in der Elektronikindustrie verwendet. Andererseits sind Aktiniden, darunter Elemente wie Uran und Plutonium, von großer Bedeutung in der Kerntechnik und Energieerzeugung.
Andere Familien
Zusätzlich zu den oben genannten Familien gibt es im Periodensystem weitere Gruppen von Elementen mit einzigartigen Merkmalen und Eigenschaften.
Beispielsweise enthält Gruppe 3 die „leichten Lanthanoide“ und Gruppe 16 die „Chalkogene“, zu denen Sauerstoff, Schwefel und Selen gehören.