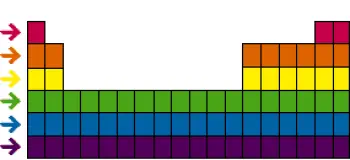
Das Periodensystem der Elemente ist eines der mächtigsten und grundlegendsten Werkzeuge der Chemie. Zusätzlich zu Familien oder Gruppen ist das Periodensystem auch in horizontale „Perioden“ oder „Zeilen“ unterteilt.
Perioden sind für das Verständnis der Chemie der Elemente von großer Bedeutung, da sie eine geordnete Anordnung von Elektronen in den elektronischen Hüllen von Atomen darstellen.
Die Struktur einer Periode
Jede Periode des Periodensystems stellt eine zusätzliche Elektronenhülle in den Atomen der Elemente dar, wenn wir uns in der Tabelle von links nach rechts bewegen. Beginnend mit der ersten Periode oben, die nur zwei Elemente (Wasserstoff und Helium) enthält, haben die Elemente in jeder Periode die gleiche Anzahl an Elektronenhüllen.
Beispiele
In der zweiten Periode beispielsweise haben Elemente wie Lithium, Beryllium, Bor, Kohlenstoff, Stickstoff, Sauerstoff, Fluor und Neon alle zwei elektronische Schalen in ihren Atomen.
In der dritten Periode haben Elemente wie Natrium, Magnesium, Aluminium, Silizium, Phosphor, Schwefel, Chlor und Argon drei Elektronenschalen und so weiter, während wir zu niedrigeren Perioden übergehen.
Eigenschaften von Elementen in einer Periode
Elemente im gleichen Zeitraum weisen chemische und physikalische Eigenschaften auf, die bestimmten Mustern und Trends folgen:
Atomgröße

Denn wenn Protonen und Elektronen derselben Elektronenhülle hinzugefügt werden, erhöht sich die effektive Kernladung, wodurch die Elektronen stärker zum Kern hingezogen werden und sich die Größe des Atoms verringert.
Elektronegativität
Die Elektronegativität, die die Tendenz eines Atoms misst, gemeinsame Elektronen in einer chemischen Bindung anzuziehen, nimmt tendenziell zu, wenn wir uns in einer Periode von links nach rechts bewegen.
Elemente auf der rechten Seite einer Periode sind elektronegativer als diejenigen auf der linken.
Reaktivität
Elemente in derselben Spalte des Periodensystems (in derselben Gruppe oder Familie) neigen dazu, ähnliche chemische Eigenschaften zu haben, da sie die gleiche Anzahl an Elektronen in ihrer Valenzschale haben.
Mit der Zeit jedoch, wenn wir uns von links nach rechts bewegen, neigen Elemente dazu, in ihrem chemischen Verhalten weniger metallisch und eher nichtmetallisch zu werden.
Beispielsweise sind Alkalimetalle der Gruppe 1 hochreaktiv, während Elemente auf der rechten Seite einer Periode, wie Fluor und Sauerstoff, Nichtmetalle sind und dazu neigen, kovalente Verbindungen zu bilden.
Ionisationsenergie
Die Ionisierungsenergie, also die Energie, die erforderlich ist, um ein Elektron aus einem Atom zu entfernen, nimmt im Allgemeinen zu, wenn wir uns in einer Periode von links nach rechts bewegen.
Elemente auf der rechten Seite einer Periode haben höhere Ionisierungsenergien, was bedeutet, dass es schwieriger ist, ein Elektron aus ihren Atomen zu entfernen.
Bedeutung von Perioden
 Die Perioden im Periodensystem sind von grundlegender Bedeutung für das Verständnis, wie die elektronische Struktur von Atomen ihr chemisches Verhalten beeinflusst. Durch die Beobachtung von Trends in den Eigenschaften von Elementen über einen bestimmten Zeitraum können Chemiker vorhersagen, wie Atome interagieren und chemische Verbindungen bilden.
Die Perioden im Periodensystem sind von grundlegender Bedeutung für das Verständnis, wie die elektronische Struktur von Atomen ihr chemisches Verhalten beeinflusst. Durch die Beobachtung von Trends in den Eigenschaften von Elementen über einen bestimmten Zeitraum können Chemiker vorhersagen, wie Atome interagieren und chemische Verbindungen bilden.
Darüber hinaus sind Periodeninformationen auch in der anorganischen Chemie und der Verbindungssynthese wertvoll.
Wenn Sie beispielsweise versuchen, eine neue chemische Verbindung zu synthetisieren, kann die Kenntnis der Eigenschaften der Elemente im gleichen Zeitraum den Wissenschaftlern dabei helfen, die geeigneten Elemente auszuwählen, die in der gewünschten Weise reagieren.
Abschluss
Die Perioden des Periodensystems sind ein wesentlicher Bestandteil seiner Organisation und spielen eine entscheidende Rolle für das Verständnis der Chemie der Elemente.
Wenn wir uns in einer Periode von links nach rechts bewegen, können wir beobachten, wie sich die Eigenschaften und das Verhalten der Elemente aufgrund der Hinzufügung elektronischer Hüllen und der Variation der effektiven Kernladung systematisch ändern.
Diese geordnete Organisation der Elemente in Perioden erinnert an die tiefe Beziehung zwischen der elektronischen Struktur der Atome und ihrer zugrunde liegenden Chemie.