
Daltons Atomtheorie , die 1808 vom englischen Chemiker und Physiker John Dalton vorgeschlagen wurde , markierte einen Wendepunkt in der Entwicklung der modernen Chemie.
Obwohl die Vorstellungen über die Existenz unteilbarer Teilchen, aus denen Materie besteht, auf die griechischen Philosophen Leukipp und Demokrit zurückgehen , war Dalton der Erste, der diese Ideen mit experimentellen Beweisen untermauerte, die die Atomtheorie als Schlüsselinstrument für das Verständnis chemischer Reaktionen und deren Eigenschaften etablierten der Materie.
Postulate von Daltons Modell
 Daltons Atomtheorie basiert auf einer Reihe von Prinzipien, die die Natur und das Verhalten von Atomen, den Grundeinheiten der Materie, erklären. Nachfolgend sind die vier Hauptpostulate aufgeführt:
Daltons Atomtheorie basiert auf einer Reihe von Prinzipien, die die Natur und das Verhalten von Atomen, den Grundeinheiten der Materie, erklären. Nachfolgend sind die vier Hauptpostulate aufgeführt:
- Elemente bestehen aus unteilbaren Atomen : Laut Dalton sind Atome extrem kleine, unteilbare und unzerstörbare Teilchen, aus denen die chemischen Elemente bestehen. Dieses Prinzip spiegelte die Idee wider, dass Atome nicht in kleinere Teilchen zerlegt werden können.
- Atome desselben Elements sind identisch : Alle Atome eines bestimmten Elements haben die gleichen Eigenschaften, einschließlich Masse und Größe. Dies bedeutet, dass beispielsweise jedes Sauerstoffatom mit jedem anderen Sauerstoffatom identisch ist.
- Atome verschiedener Elemente können sich zu Verbindungen verbinden : Chemische Verbindungen entstehen durch die Kombination von Atomen zweier oder mehrerer Elemente in definierten und einfachen Verhältnissen. Dieses Prinzip half zu erklären, wie sich Elemente in festen Verhältnissen verbinden, um neue Substanzen zu schaffen.
- Bei chemischen Reaktionen kommt es zur Neuanordnung von Atomen : Bei einer chemischen Reaktion werden Atome neu angeordnet, aber weder erzeugt noch zerstört. Dies bekräftigt das Prinzip der Erhaltung der Materie bei chemischen Reaktionen, ein Konzept, das bereits von Antoine Lavoisier aufgestellt wurde.
Einschränkungen und Fehler
 Obwohl Daltons Atomtheorie für ihre Zeit einen bedeutenden Fortschritt darstellte, war sie nicht frei von Fehlern und Einschränkungen. Mit der Entwicklung der Physik und Chemie im 19. und frühen 20. Jahrhundert wurden mehrere Aspekte entdeckt, die nicht zu Daltons ursprünglichem Modell passten:
Obwohl Daltons Atomtheorie für ihre Zeit einen bedeutenden Fortschritt darstellte, war sie nicht frei von Fehlern und Einschränkungen. Mit der Entwicklung der Physik und Chemie im 19. und frühen 20. Jahrhundert wurden mehrere Aspekte entdeckt, die nicht zu Daltons ursprünglichem Modell passten:
- Atome sind nicht unteilbar : Einer der Hauptfehler in Daltons Theorie ist die Vorstellung, dass Atome die kleinsten und unteilbarsten Teilchen der Materie seien. Im späten 19. Jahrhundert zeigte die Entdeckung subatomarer Teilchen wie Elektronen, Protonen und Neutronen, dass Atome tatsächlich aus noch kleineren Teilchen bestehen.
- Existenz von Isotopen : Dalton ging davon aus, dass alle Atome desselben Elements identisch seien. Mit der Entdeckung der Isotope zu Beginn des 20. Jahrhunderts wurde jedoch gezeigt, dass Atome eines Elements aufgrund der Anwesenheit unterschiedlicher Neutronenzahlen unterschiedliche Massen haben können. Wasserstoffatome haben beispielsweise drei Isotope: Protium, Deuterium und Tritium, die sich in der Anzahl der Neutronen unterscheiden.
- Atome können unter bestimmten Bedingungen zerfallen : Dalton postulierte, dass Atome unzerstörbar seien, doch Fortschritte in der Kernphysik zeigten, dass Atome durch Kernreaktionen wie Spaltung und Fusion oder durch radioaktiven Zerfall zerfallen können. Diese Prozesse ermöglichen es Atomen, Energie freizusetzen oder sich in andere Elemente umzuwandeln.
- Nicht alle Verbindungen sind einfache Kombinationen von Atomen : Daltons Theorie legte nahe, dass Verbindungen einfache Kombinationen von Atomen verschiedener Elemente waren. Die Entstehung komplexerer Verbindungen und das Verständnis molekularer Strukturen haben jedoch gezeigt, dass die Wechselwirkungen zwischen Atomen viel komplexer sein können, als Dalton es sich vorgestellt hatte.
- Daltons Modell erklärt keine elektrischen Wechselwirkungen : Obwohl Dalton erkannte, dass Atome sich zu Verbindungen verbinden können, konnte er nicht erklären, wie diese Kombinationen zustande kamen. Erst mit dem Aufkommen von Thomsons Atommodell und der Entdeckung des Elektrons begann man zu verstehen, welche entscheidende Rolle elektrische Wechselwirkungen bei der Bildung chemischer Verbindungen spielen.
Die Gewichtsgesetze der Chemie
Daltons Atomtheorie lieferte nicht nur eine neue Perspektive auf die Natur der Materie, sondern erklärte auch mehrere physikalische Gesetze, die aus den Gewichtsgesetzen der Chemie bekannt waren und die Wissenschaftler bereits beobachtet hatten. Zu diesen Gesetzen gehören:
Gesetz der Massenerhaltung
Das Ende des 18. Jahrhunderts von Antoine Lavoisier formulierte Massenerhaltungsgesetz besagt, dass die Gesamtmasse der Stoffe in einer chemischen Reaktion konstant bleibt. Mit anderen Worten: Die Gesamtmenge an Materie vor und nach einer chemischen Reaktion ist gleich.
Daltons Atomtheorie lieferte eine logische Erklärung für dieses Gesetz, da nach seinem Modell Atome bei chemischen Reaktionen weder zerstört noch neu entstehen, sondern lediglich in unterschiedliche Konfigurationen umgeordnet werden.
Gesetz bestimmter Proportionen
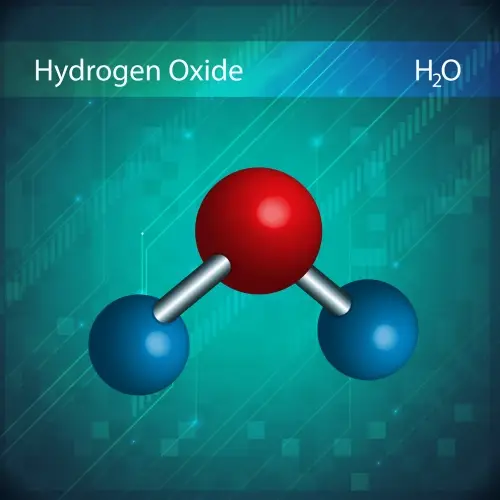 Das von Joseph Proust 1799 vorgeschlagene Gesetz der bestimmten Proportionen besagt, dass eine chemische Verbindung immer dieselben Elemente im gleichen Massenverhältnis enthält.
Das von Joseph Proust 1799 vorgeschlagene Gesetz der bestimmten Proportionen besagt, dass eine chemische Verbindung immer dieselben Elemente im gleichen Massenverhältnis enthält.
Beispielsweise hat Wasser (H₂O) unabhängig von der analysierten Wassermenge immer ein Verhältnis von 2 Gramm Wasserstoff zu 16 Gramm Sauerstoff.
Daltons Atomtheorie erklärte dieses Gesetz, indem sie vorschlug, dass Verbindungen aus Atomen verschiedener Elemente bestehen, die in festen Verhältnissen kombiniert sind.
Gesetz der multiplen Proportionen
Ein weiteres Grundgesetz, das Dalton mit seiner Atomtheorie erklärte, ist das von ihm selbst formulierte Gesetz der multiplen Proportionen. Dieses Gesetz besagt, dass, wenn sich zwei Elemente zu mehr als einer Verbindung verbinden, die Mengen eines der Elemente, die sich mit einer festen Menge des anderen Elements verbinden, in einem Verhältnis einfacher ganzer Zahlen stehen.
Beispielsweise können sich Kohlenstoff und Sauerstoff zu Kohlendioxid (CO₂) und Kohlenmonoxid (CO) verbinden. In Kohlendioxid gibt es für jedes Kohlenstoffatom zwei Sauerstoffatome, während es in Kohlenmonoxid nur eines gibt.
Das bedeutet, dass die Menge an Sauerstoff, die sich mit einer festen Menge an Kohlenstoff verbindet, in einem Verhältnis von 2:1 vorliegt, was die Idee unterstützt, dass sich Atome in einfachen, definierten Verhältnissen verbinden.
Auswirkungen auf die Entwicklung der Wissenschaft
Trotz ihrer Einschränkungen hatte Daltons Atomtheorie einen tiefgreifenden Einfluss auf die Wissenschaft und legte den Grundstein für die Entwicklung der modernen Chemie. Sein quantitativer Ansatz zur Kombination von Elementen ermöglichte es Wissenschaftlern, chemische Gleichungen zu formulieren und Reaktionen systematisch zu untersuchen. Darüber hinaus war Daltons Atommodell maßgeblich an der Entwicklung anderer wichtiger wissenschaftlicher Theorien beteiligt, beispielsweise der Theorie der Atomorbitale , der Quantentheorie und des Standardmodells der Teilchenphysik .
Daltons Modell beeinflusste auch die Entwicklung des Periodensystems der Elemente, das 1869 von Dmitri Mendelejew auf der Grundlage der Beziehung zwischen den Eigenschaften der Elemente und ihren Atommassen aufgestellt wurde. Dieser Fortschritt ermöglichte es, Elemente kohärent zu klassifizieren und die Eigenschaften noch nicht entdeckter Elemente vorherzusagen.
Entwicklung der Atomtheorie nach Dalton
Im Laufe der Zeit wurde Daltons Atomtheorie verfeinert und durch genauere Modelle ersetzt.
Einer der bedeutendsten Fortschritte war Thomsons Atommodell, auch bekannt als „Plum Pudding“-Modell, das 1897 vorgeschlagen wurde. In diesem Modell bestand das Atom aus einer positiven Masse mit darin eingebetteten Elektronen. Obwohl dieses Modell später abgelöst wurde, war es ein entscheidender Schritt auf dem Weg zur Entwicklung von Rutherfords Atommodell, das die Idee eines dichten Kerns im Zentrum des Atoms einführte.
Im Jahr 1911 führte Ernest Rutherford sein berühmtes Goldfolienexperiment durch, das zeigte, dass der größte Teil der Masse des Atoms in einem zentralen Kern konzentriert ist, um den Elektronen kreisen. Dieses Modell veränderte die Sicht auf das Atom radikal und legte nahe, dass es keine feste Masse war, sondern hauptsächlich aus leerem Raum bestand.
 Später verbesserte Niels Bohrs 1913 vorgeschlagenes Atommodell Rutherfords Modell durch die Einführung quantisierter Energieniveaus für Elektronen. Laut Bohr könnten Elektronen nur bestimmte Umlaufbahnen um den Kern einnehmen und würden nur dann Energie abgeben oder absorbieren, wenn sie sich zwischen diesen Ebenen bewegen.
Später verbesserte Niels Bohrs 1913 vorgeschlagenes Atommodell Rutherfords Modell durch die Einführung quantisierter Energieniveaus für Elektronen. Laut Bohr könnten Elektronen nur bestimmte Umlaufbahnen um den Kern einnehmen und würden nur dann Energie abgeben oder absorbieren, wenn sie sich zwischen diesen Ebenen bewegen.
Obwohl Bohrs Modell nicht alle in den komplexesten Atomen beobachteten Phänomene erklärte, war es grundlegend für die Einführung der Quantenmechanik in die Beschreibung der Atomstruktur.
Mit dem Aufkommen der Quantenmechanik ersetzten das Schrödinger-Modell und die Schrödinger-Wellengleichung die Idee fester Bahnen durch Orbitale , bei denen es sich um Raumregionen handelt, in denen sich ein Elektron am wahrscheinlichsten aufhält. Anstatt Elektronen als Teilchen zu betrachten, die den Kern auf definierten Flugbahnen umkreisen, beschreibt das Quantenmodell Elektronen als Wahrscheinlichkeitswellen.
Diese Vorstellung wurde durch die Heisenbergsche Unschärferelation weiter vorangetrieben , die besagt, dass es nicht möglich ist, die Position und Geschwindigkeit eines Elektrons gleichzeitig genau zu kennen.
Abschluss
Daltons Atomtheorie leitete eine neue Ära in der Wissenschaft ein und lieferte eine solide Grundlage für das Studium von Materie und chemischen Reaktionen. Obwohl sich sein Modell als vereinfacht und in mancher Hinsicht falsch herausstellte, legte es den Grundstein für ein tieferes Verständnis der Atomstruktur und der Gesetze, die die Wechselwirkungen zwischen Elementen regeln.
Im Laufe der Zeit entwickelte sich die Atomtheorie weiter, da neue Entdeckungen gemacht wurden. Modelle wie die von Rutherford , Bohr und schließlich die Quantenmechanik von Schrödinger und Heisenberg erweiterten unser Verständnis des Atoms und ermöglichten es Wissenschaftlern, komplexe Phänomene zu erklären, die Daltons Modell nicht behandeln konnte.
Auch heute noch sind Atome die Grundpfeiler des Studiums der Chemie und Physik. Obwohl der technologische Fortschritt es uns ermöglicht hat, tiefer in die subatomare Struktur einzutauchen, bleibt Daltons Vision in vielen Aspekten der Materieforschung relevant.
Die Fähigkeit von Atomen, sich in definierten Verhältnissen zu Verbindungen zu verbinden, bleibt ein Schlüsselprinzip der Chemie, und ihre Theorie gilt, obwohl veraltet, als einer der Eckpfeiler der wissenschaftlichen Entwicklung.
John Daltons Vermächtnis in der Wissenschaft ist unbestreitbar. Sein Beharren auf der Bedeutung empirischer Beobachtung und sein quantitativer Ansatz zum Verständnis der Materie legten den Grundstein für die moderne Chemie, und obwohl spätere Entdeckungen zeigten, dass seine Sicht auf das Atom unvollständig war, bleibt sein Beitrag ein Meilenstein in der Geschichte der Chemie.