Ein Proton ist ein subatomares Teilchen mit einer positiven elektrischen Ladung, das sich im Atomkern von Atomen befindet. Die Zahl dieses Unterteilchens im Atomkern bestimmt die Ordnungszahl. Die chemischen Elemente sind im Periodensystem der Elemente entsprechend der Ordnungszahl geordnet.
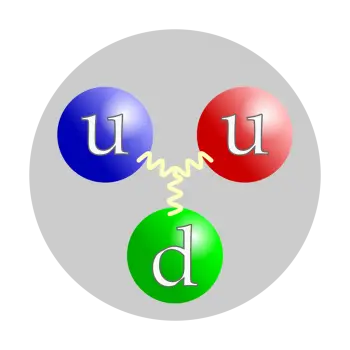
Das Proton ist kein Elementarteilchen, sondern ein zusammengesetztes Teilchen. Es besteht aus drei an Gluonen gebundenen Teilchen, zwei Up- Quarks und einem Down-Quark. Diese Struktur bedeutet, dass es sich um ein Baryon handelt (eine Unterart von Teilchen, die Hadronen genannt werden).
Diese atomaren Unterteilchen sind in Atomkernen vorhanden und werden im Allgemeinen durch eine starke Kernkraft an Neutronen gebunden. Protonen und Neutronen sind die kleineren Teilchen des Atomkerns, daher werden sie auch Nukleonen genannt. Die einzige Ausnahme, bei der es ohne Neutronen einen Atomkern bildet, ist der Kern eines gewöhnlichen Wasserstoffatoms - das häufigste Nuklid im Universum.
Wasserstoff hat jedoch andere Isotope, die Neutronen enthalten. Beispielsweise enthalten die Kerne der schweren Wasserstoffisotope (Deuterium und Tritium) ein Proton und ein bzw. zwei Neutronen. Diese beiden Wasserstoffisotope werden als Kernbrennstoff in Kernfusionsreaktionen verwendet. Alle anderen Atomarten bestehen aus zwei oder mehr Protonen und unterschiedlich vielen Neutronen.
Sie können existieren in:
-
Plasmen: Sie sind der vierte Aggregatzustand der Materie. Es ist ein flüssiger Zustand ähnlich dem gasförmigen Zustand, in dem jedoch ein bestimmter Anteil seiner Teilchen elektrisch geladen (ionisiert) ist und kein elektromagnetisches Gleichgewicht besitzt.
-
Die kosmische Strahlung, das sind subatomare Teilchen, die mit einer sehr hohen kinetischen Energie aus dem Weltraum kommen.
-
Sonnenwind: Es ist ein Strom geladener Teilchen, der aus der oberen Atmosphäre der Sonne freigesetzt wird.
Was ist die Lebensdauer eines Protons?
Seine Lebensdauer beträgt ungefähr 10 35 Jahre, daher gilt es auf praktischer Ebene als ewig.
Aus Sicht des Standardmodells der Teilchenphysik sind sie stabile Teilchen. Die Gesetze der Physik erlauben es einem Nukleon nicht, sich spontan zu zersetzen, weil die Anzahl der Baryonen erhalten bleibt.
Wie groß ist die Masse eines Protons?
Es hat eine Masse von etwa 1,6726219 × 10 -27 Kilogramm.
Dieser Wert entspricht ungefähr der Masse von Neutronen. Im Vergleich zum Elektron ist die Masse des Protons jedoch etwa 1.836-mal größer.
Wie groß ist die elektrische Ladung eines Protons?
Das Proton hat eine positive Elementarladung von 1.602 x 10 -19 Coulomb.
Protonen und Elektronen haben die gleiche absolute Ladung, jedoch mit entgegengesetzten Vorzeichen. Daher haben neutrale Atome die Anzahl von Elektronen und Protonen müssen gleich sein.
Warum sind Protonen notwendig?
Protonen sind essentiell, weil sie definieren, welches Element ein Atom ist.
Die Ordnungszahl (Z) ist die Anzahl der Protonen in seinem Kern und bestimmt die chemischen Eigenschaften des Atoms.
Die Anzahl der Neutronen (N) wird auch verwendet, indem alle Nukleonen addiert werden, um die Isotope eines Elements zu bestimmen. Daher ist die Massenzahl (A) die Summe beider Teilteilchen.
Ein weiteres wesentliches Merkmal ist, dass seine positive Ladung dazu beiträgt, Elektronen einzufangen und sie in ihrer Umlaufbahn um den Atomkern zu halten.
Wer hat das Proton entdeckt?
Das Proton wurde 1919 von Ernest Rutherford entdeckt.

Die Geschichte seiner Entdeckung reicht bis ins Jahr 1886 zurück, als Eugene Goldstein anodische Strahlen entdeckte und zeigte, dass es sich um positiv geladene Teilchen (Ionen) handelte, die aus Gasen hergestellt wurden.
Mit seinen Experimenten beobachtete Goldstein, dass diese Teilchen unterschiedliche Werte des Verhältnisses zwischen Ladung und Masse aufwiesen. Aus diesem Grund konnte die positive Ladung mit einem Teilchen nicht identifiziert werden.
1911 stellte Ernest Rutherford sein planetarisches Atommodell vor. In diesem Modell habe ich bereits festgestellt, dass eine positive elektrische Ladung im Zentrum des Atoms konzentriert war, umgeben von Elektronen, die von Thompson mit einer negativen Ladung entdeckt wurden.
Rutherford befreite den Wasserstoffkern mithilfe einer Radioaktivitätsquelle, um energiereiche Alphateilchen zu erzeugen. Außerdem zeigte Rutherford mit seiner Forschung, dass der Wasserstoffkern in anderen Kernen vorhanden ist.
Wasserstoff ist das einzige Element im Periodensystem mit einem einzigen Proton. Wenn man von einem Wasserstoffkern sprach, war es daher, als würde man über ein Proton sprechen.