
Das Atom ist eine Struktur, in der Materie in der physischen Welt oder in der Natur organisiert ist. Seine Struktur besteht aus verschiedenen Kombinationen von drei Unterteilchen: Neutronen, Protonen und Elektronen.
Definition des Atoms: „Es ist das kleinste Teilchen, aus dem ein Element bestehen kann und durch dessen Kombination Moleküle entstehen.“
Diese Definition stammt aus dem Griechischen und bedeutet unteilbar. Als diese Teilchen benannt wurden, glaubte man, dass sie nicht geteilt werden könnten.
Atomstruktur, die Teile eines Atoms
Das Atom ist nach dem aktuellen Atommodell in zwei Teile geteilt:
-
Der Kern: Dieser Teil besteht aus Neutronen und Protonen.
-
Die Kruste: nur durch Elektronen gebildet.
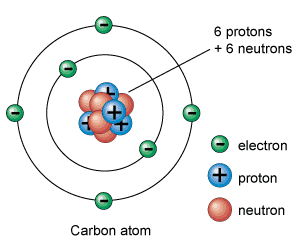
Subatomare Teilchen: Protonen, Neutronen und Elektronen
Protonen, Neutronen und Elektronen sind die subatomaren Teilchen, aus denen Atome bestehen. Die Art und Weise, wie sie untereinander organisiert sind, definiert jedes chemische Element.
Elektronen sind die leichtesten subatomaren Teilchen und haben eine negative elektrische Ladung. Protonen sind positiv geladen und wiegen etwa 1.836-mal mehr als Elektronen. Schließlich haben Neutronen keine elektrische Ladung und wiegen etwa das gleiche wie Protonen.
Protonen und Neutronen sind im Atomkern (weshalb sie auch Nukleonen genannt werden) dank der Kernkräfte, die sie zusammenhalten, zusammengefasst. Daher hat der Atomkern eine positive Ladung (die der Protonen), in der fast seine gesamte Masse konzentriert ist.
Andererseits gibt es um den Kern herum eine bestimmte Anzahl negativ geladener Elektronen. Die Gesamtladung des Kerns (positiv) ist gleich der negativen Ladung der Elektronen, die gesamte elektrische Ladung ist also neutral.
Wie wurde das aktuelle Atommodell entdeckt?
Bevor das aktuelle Wissen über die Struktur des Atoms erlangt wurde, wurden im Laufe der Geschichte verschiedene Atomtheorien über die Zusammensetzung der Materie entwickelt.
Basierend auf Atomtheorien stellen Wissenschaftler Atommodelle vor, die sich nach und nach weiterentwickelt haben.
Das erste von John Dalton vorgestellte Modell hat sich weiterentwickelt, bis es zum Atommodell von Niels Bohr gelangte. Bohr präsentierte ein dem aktuellen Modell sehr ähnliches Modell, bei dem die Elektronen um den Kern kreisen.
Eigenschaften von Atomen
Abhängig von der Zusammensetzung der Atome werden die verschiedenen chemischen Elemente unterschieden, die im Periodensystem der chemischen Elemente dargestellt sind.
 Die Eigenschaften, die Atome definieren, sind:
Die Eigenschaften, die Atome definieren, sind:
-
Die Ordnungszahl (Z) gibt die Anzahl der Protonen im Kern an. Alle Atome mit der gleichen Protonenzahl gehören zum gleichen Element. Diejenigen mit nur einem Proton sind beispielsweise Wasserstoffatome.
-
Die Massenzahl bezeichnet die Summe von Protonen und Neutronen. Elemente mit unterschiedlicher Neutronenzahl gehören zu unterschiedlichen Isotopen desselben Elements.
-
Elektronegativität ist die Tendenz eines Atoms, Elektronen anzuziehen, wenn es eine chemische Bindung eingeht.
-
Der Atomradius entspricht dem halben Abstand zwischen zwei miteinander verbundenen Kernen desselben Elements.
-
Das Ionisationspotential ist die Energie, die erforderlich ist, um ein Elektron vom Element zu trennen.
Beziehung von Atomen zu Molekülen
Ein Molekül entsteht, wenn zwei oder mehr Atome durch chemische Bindungen verbunden werden. Atome können durch Bindungen miteinander verbunden werden. Diese Bindungen entstehen, wenn Atome Elektronen teilen, gewinnen oder verlieren, um eine stabilere elektronische Konfiguration zu erreichen.
In einem Molekül sind die Atome in einer dreidimensionalen Struktur angeordnet und werden durch chemische Bindungen zusammengehalten. Die Art und Weise, wie die Atome in einem Molekül verbunden sind, bestimmt dessen chemische und physikalische Eigenschaften sowie sein Verhalten bei chemischen Reaktionen.
Woher kommt die Energie der Atome?
Die Energie der Atome stammt hauptsächlich aus zwei Quellen:
- die Kernenergie
- elektronische Energie.
Kernenergie
Kernenergie hängt mit den Kräften zusammen, die Atomkerne zusammenhalten. Kernenergie wird bei Kernprozessen wie Kernspaltung und Kernfusion freigesetzt oder absorbiert. Bei der Kernspaltung wird ein schwerer Kern in kleinere Kerne gespalten und bei der Kernfusion verbinden sich zwei leichte Kerne zu einem schwereren Kern. Beide Prozesse setzen Energie aufgrund der unterschiedlichen Massen der beteiligten Kerne frei, gemäß Einsteins berühmter Gleichung E = mc².
Elektronische Energie
Elektronische Energie wiederum ist mit der Konfiguration der Elektronen in Atomen verbunden. Elektronen umkreisen den Atomkern in Energieniveaus oder Elektronenhüllen.
Elektronen können sich zwischen diesen Energieniveaus bewegen, indem sie Energie in Form von Photonen absorbieren oder abgeben. Wenn Elektronen Energie absorbieren, können sie auf höhere Energieniveaus springen. Wenn sie Energie freisetzen, kehren sie auf niedrigere Energieniveaus zurück.
Diese Änderungen der elektronischen Energie sind für die Emission und Absorption von Licht sowie anderen Formen elektromagnetischer Strahlung, beispielsweise Röntgenstrahlen, verantwortlich.