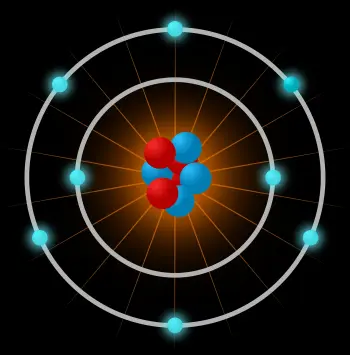
Ein Atom ist die kleinste Baueinheit gewöhnlicher Materie, die die Eigenschaften eines chemischen Elements hat. Das Atom besteht aus:
-
Der Atomkern: gebildet von subatomaren Teilchen, die Nukleonen genannt werden. Nukleonen können Neutronen oder Protonen sein.
-
Eine Elektronenwolke: eine andere Art von subatomaren Teilchen, die sich um den Kern bewegen.
Der Hauptunterschied zwischen Protonen, Neutronen und Elektronen ist ihre elektrische Ladung. Elektronen haben eine negative elektrische Ladung, Protonen haben eine positive Ladung und Neutronen sind Teilchen mit einer neutralen elektrischen Ladung.
Neutrale Atome haben die gleiche Anzahl von Elektronen wie Protonen, da beide Unterteilchen die gleiche elektrische Ladung haben.
Ein Atom besteht aus einem sehr dichten zentralen Kern mit nahe beieinander liegenden Nukleonen und Elektronen, die sich in relativ großer Entfernung um den Kern bewegen.
Struktur des Atomkerns
Der Atomkern ist der zentrale Teil des Atoms, der aus Nukleonen besteht, die durch sehr starke Bindungen miteinander verbunden sind. Ein Nukleon kann ein Proton oder ein Neutron sein.
Da Protonen eine positive elektrische Ladung und Neutronen eine neutrale Ladung haben, besteht die natürliche Tendenz zur Trennung. Die Bindungen, die die Nukleonen zusammenhalten, üben auf kurze Distanz eine viel stärkere Kernkraft aus als die elektromagnetische Kraft .
Die Stärke dieser Kernbindungen ermöglicht es, die elektrische Abstoßung zwischen den Protonen zu überwinden.
Was ist die Massenzahl eines Atoms?
Die Massenzahl eines Atoms ist die Anzahl der Nukleonen in seinem Atomkern, also die Summe aus Protonen und Neutronen.
Das Volumen des Kerns ist ungefähr proportional zur Gesamtzahl der Nukleonen, der Massenzahl.
Was stellt die Ordnungszahl dar?
Die Ordnungszahl ist die Anzahl der Protonen, die ein Atom hat und wird durch Z dargestellt.
Atome werden nach der Ordnungszahl in das Periodensystem der Elemente eingeordnet.
Isotope: Atome mit anderer Kernzusammensetzung
Die Atome eines chemischen Elements müssen die gleiche Anzahl von Protonen haben, sie können jedoch eine unterschiedliche Anzahl von Neutronen haben. Atome desselben Elements mit unterschiedlicher Neutronenzahl werden Isotope genannt.
Isotope kommen in der Natur vor, können aber auch manipuliert werden. Zum Beispiel besteht die Urananreicherung darin, die Anzahl der Neutronen in einem Uranatom zu erhöhen, um es instabiler zu machen und Spaltungsreaktionen zu begünstigen.
Was ist die Elektronenwolke?
Das Elektron ist ein stabiles Elementarteilchen mit der kleinsten negativen Ladung, die es in der Natur gibt. Diese Ladung wird als Elementarladung bezeichnet, da jede trennbare elektrische Ladung aus einer ganzen Zahl von ihnen besteht.
Die Elektronen haben eine negative elektrische Ladung, daher werden sie von den Protonen mit positivem Vorzeichen im Atom durch die elektromagnetische Kraft angezogen. Diese Kraft nimmt zu, indem der Abstand zwischen Elektron und Kern verringert wird.
Die Existenz des Elektrons wurde von JJ Thomson entdeckt. Von diesem Moment an tauchte es bereits in allen zukünftig entwickelten Atommodellen auf.
Atomorbitale: die Wahrscheinlichkeit, ein Elektron an einem Punkt zu finden
Elektronen neigen dazu, eine bestimmte Art von stehenden Wellen um den Atomkern zu bilden. Jede dieser Wellen ist durch ein Atomorbital gekennzeichnet, eine mathematische Funktion, die die Wahrscheinlichkeit beschreibt, das Elektron an jedem Punkt im Raum zu finden.
Die Elektronenwolke ist die von diesen Wellen besetzte Region, die als negative Ladungsdichte um den Kern herum visualisiert wird.
Jedes Orbital entspricht einem möglichen Energiewert für Elektronen. Ein Elektron kann jedoch auf ein höheres oder niedrigeres Niveau springen, indem es Energie einfängt oder emittiert.
Das Konzept des Atomorbitals wurde erstmals in Schrödingers Atommodell eingeführt.
Wie wichtig ist die Zusammensetzung eines Atoms für die Kernenergie?
Die Grundlage für alles, was mit Kernenergie zu tun hat, liegt im Atomkern, denn die Kerntechnik beruht auf der Nutzung der in den Atomen enthaltenen inneren Energie.
Kernenergie wird aus der Teilung eines Atomkerns (Kernspaltung) oder aus der Verschmelzung zweier Atomkerne (Kernfusion) gewonnen.
Wenn dies geschieht und sich die Struktur des Atoms ändert, wird eine große Menge an Wärmeenergie freigesetzt.
Kernreaktionen: Spaltung und Verschmelzung von Atomen
Der Atomkern kann durch sehr energetische Prozesse verändert werden, die eine Veränderung der Atomstruktur bewirken können. Instabile Uran- und Plutoniumkerne können Zerfällen unterliegen, die durch die Emission von Strahlung die Anzahl der Protonen und Neutronen verändern können.
Ein schwerer Kern kann in einer Kernreaktion oder spontan in leichtere Kerne spalten. Mit ausreichend Energie können zwei oder mehr Kerne zu einem schwereren verschmelzen, in diesem Fall handelt es sich um eine Kernfusionsreaktion.
Chemische Elemente mit niedriger Ordnungszahl, Kerne mit unterschiedlicher Anzahl von Protonen und Neutronen neigen dazu, in Kerne mit ähnlicheren Proportionen zu zerfallen. Die schwereren Elemente benötigen jedoch einen höheren Neutronenanteil, um den Kern zu stabilisieren.



