Isotope sind Atome, deren Atomkerne die gleiche Anzahl an Protonen, aber eine unterschiedliche Anzahl an Neutronen haben. Nicht alle Atome desselben Elements sind identisch und jede dieser Varianten entspricht einem anderen Isotop.
Das Wort Isotop wird verwendet, um anzuzeigen, dass sich alle Arten von Atomen eines chemischen Elements an derselben Stelle im Periodensystem befinden.
Isotopendefinition
Gemäß der Isotopendefinition hat jedes gleiche Element die gleiche Ordnungszahl (Z), aber jedes hat eine unterschiedliche Massenzahl (A). Die Ordnungszahl entspricht der Anzahl der Protonen im Atomkern des Atoms. Die Massenzahl entspricht der Summe der Neutronen und Protonen im Kern.
Das bedeutet, dass sich die verschiedenen Isotope desselben Atoms nur durch die Anzahl der Neutronen unterscheiden.
Obwohl sie eine beliebige Anzahl von Neutronen haben können, gibt es einige bevorzugte Kombinationen von Protonen und Neutronen in verschiedenen Atomen.
Diejenigen, die leicht sind (mit wenigen Protonen und Neutronen), haben tendenziell die gleiche Anzahl an Neutronen und Protonen, während die schwersten tendenziell mehr Neutronen als Protonen haben.
Arten von Isotopen
Isotope können aufgrund ihrer Stabilität in drei Hauptkategorien eingeteilt werden:
-
Stabile Isotope: Sind solche, die keinem radioaktiven Zerfall unterliegen. Diese Isotope verfügen über eine ausgewogene Mischung aus Protonen und Neutronen in ihrem Kern, was ihnen Langzeitstabilität verleiht. Zum Beispiel Kohlenstoff-12, Sauerstoff-16 oder Kalzium-40.
-
Instabile oder radioaktive Isotope: Dabei handelt es sich um Isotope, die einem radioaktiven Zerfall unterliegen und dabei subatomare Teilchen oder Strahlung aussenden, um eine stabilere Konfiguration zu erreichen. Radioaktive Isotope weisen im Vergleich zur stabilsten Konfiguration entweder einen Überschuss oder einen Mangel an Neutronen auf. Einige Beispiele sind Uran-238, Plutonium-239 oder Kohlenstoff-14.
-
Halbstabile Isotope oder Radioisotope: Dies sind Isotope, die instabil sind, aber eine lange Halbwertszeit haben. Sein radioaktiver Zerfall ist im Vergleich zu anderen radioaktiven Isotopen langsamer. Beispiele hierfür sind Kalium-40 und Cäsium-137.
Instabile Isotope: Definition und Beispiele
Instabile Isotope, auch Radioisotope genannt, sind Isotope, die einem radioaktiven Zerfall unterliegen und dabei subatomare Teilchen oder Strahlung emittieren, um eine stabilere Konfiguration zu erreichen.
Diese Isotope weisen im Vergleich zur stabilsten Konfiguration einen Überschuss oder einen Mangel an Neutronen auf, was sie instabil und anfällig für Kernzerfall macht.
Hier sind einige Beispiele für instabile Isotope und einige ihrer Anwendungen:
-
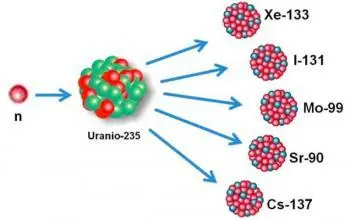
Uran-238 (238U): Es ist ein instabiles Uranisotop und kommt natürlicherweise in der Erdkruste vor. Es ist die Vorstufe des radioaktiven Isotops Uran-235, das zur Erzeugung von Kernenergie und zur Herstellung von Atomwaffen verwendet wird.
-
Plutonium-239 (239Pu): Es ist ein instabiles Isotop von Plutonium und wird in Kernreaktoren aus dem Uran-238-Isotop hergestellt. Es wird bei der Herstellung von Atomwaffen und in Kernspaltungsreaktoren eingesetzt.
-
Kohlenstoff-14 (14C): Es ist ein instabiles Kohlenstoffisotop, das sich in der Atmosphäre durch die Wechselwirkung kosmischer Strahlung bildet. Es wird bei der Radiokarbondatierung verwendet, um das Alter archäologischer und geologischer Objekte zu bestimmen.
-
Jod-131 (131I): Es ist ein instabiles Jodisotop und wird in Kernreaktoren produziert. Es wird in der Nuklearmedizin zur Behandlung von Schilddrüsenüberfunktion und Schilddrüsenkrebs eingesetzt, da es Beta- und Gammastrahlung aussendet, die abnormale Schilddrüsenzellen zerstören kann.
-
Cäsium-137 (137Cs): Es ist ein instabiles Isotop von Cäsium und entsteht als Nebenprodukt der Kernspaltung. Es wird in industriellen Anwendungen, in der Strahlentherapie und bei der Messung seismischer Aktivität eingesetzt.

Stabile Isotope: Definition und Beispiele
Stabile Isotope sind solche Isotope, die keinem radioaktiven Zerfall unterliegen und ihre Kernzusammensetzung über die Zeit beibehalten. Das bedeutet, dass sie in ihrem Kern über eine ausgewogene Mischung aus Protonen und Neutronen verfügen, was ihnen Langzeitstabilität verleiht.
Hier einige Beispiele für stabile Isotope und ihre Anwendungen:
-
Kohlenstoff-12 (12C): Es ist das am häufigsten vorkommende Kohlenstoffisotop auf der Erde. Es wird in der organischen Chemie als Referenz zur Bestimmung von Molekülmassen und in der Massenspektrometrie zur Gerätekalibrierung verwendet.
-
Sauerstoff-16 (16O): Es ist das häufigste Sauerstoffisotop und kommt in der Atmosphäre, im Wasser und in Mineralien vor. Es wird bei der Zellatmung und bei der Bildung chemischer Bindungen in vielen biologischen Reaktionen verwendet.
-
Wasserstoff-1 (1H): Es ist das häufigste Wasserstoffisotop und wird in einer Vielzahl von Anwendungen eingesetzt. Es ist wichtig für die Bildung biologischer Moleküle wie Wasser und wird bei der Herstellung von Ammoniak und anderen Chemikalien verwendet.
-
Stickstoff-14 (14N): Es ist das häufigste Stickstoffisotop und kommt in großen Mengen in der Atmosphäre vor. Es wird bei der Synthese von Düngemitteln und bei Urananreicherungsprozessen eingesetzt.
-
Calcium-40 (40Ca): Es ist das am häufigsten vorkommende Calciumisotop auf der Erde und kommt in Knochen, Zähnen und anderen Geweben vor. Es ist wichtig für die Muskelkontraktion, die Blutgerinnung und den Knochenaufbau.
Halbstabile Isotope: Definition und Beispiele
Halbstabile Isotope, auch langlebige Isotope genannt, sind Isotope, die im Vergleich zu typischen radioaktiven Isotopen eine deutlich längere Halbwertszeit haben.
Obwohl sie instabil sind und schließlich zerfallen, ist ihre Halbwertszeit lang genug, um als „halbstabil“ gelten zu können.
Einige Beispiele für halbstabile Isotope:
-
Kalium-40 (40K): Es ist ein halbstabiles Kaliumisotop mit einer Halbwertszeit von etwa 1,3 Milliarden Jahren. Es wird bei der radiometrischen Datierung von Gesteinen und Mineralien verwendet, insbesondere bei der Datierung von Vulkangesteinen.
-
Rubidium-87 (87Rb): Es ist ein halbstabiles Rubidiumisotop mit einer Halbwertszeit von etwa 49 Milliarden Jahren. Es wird bei der radiometrischen Datierung von Mineralien und Gesteinen verwendet, insbesondere bei der Datierung von Mineralien wie Feldspat.
-
Samarium-147 (147Sm): Es ist ein halbstabiles Isotop von Samarium mit einer Halbwertszeit von etwa 106 Milliarden Jahren. Es wird bei der radiometrischen Datierung von Mineralien und Gesteinen verwendet, insbesondere bei der Datierung von Mineralien wie Apatit.
-
Uran-235 (235U): Obwohl es als instabiles Isotop gilt, gehört es aufgrund seiner Halbwertszeit von etwa 704 Millionen Jahren zu einer Zwischenkategorie. Es wird in der Kernenergieindustrie als Brennstoff in Kernreaktoren verwendet und ist auch für die Herstellung von Atomwaffen wichtig.
Wie groß ist die Halbwertszeit eines Isotops?
Die Halbwertszeit eines Isotops ist die durchschnittliche Zeit, die es benötigt, um auf die Hälfte seiner ursprünglichen Menge zu zerfallen. Es ist ein Maß zur Beschreibung der Stabilität oder Zerfallsrate eines radioaktiven Isotops.
Wenn ein radioaktives Isotop zerfällt, emittiert es subatomare Teilchen oder Strahlung, um eine stabilere Konfiguration zu erreichen. Unter Halbwertszeit versteht man die Zeit, die benötigt wird, bis die Hälfte der Atome eines bestimmten Isotops zerfällt.
Isotope natürlichen und künstlichen Ursprungs
Isotope können in zwei Hauptkategorien eingeteilt werden: natürlich vorkommende oder vom Menschen hergestellte.
natürlich vorkommende Isotope
Natürlich vorkommende Isotope kommen in der Natur vor und werden auf natürliche Weise durch geologische, astronomische und biologische Prozesse erzeugt.
Diese Isotope existieren seit der Entstehung der Erde und kommen in Mineralien, Wasser, Luft, Pflanzen, Tieren und lebenden Organismen vor.
Einige Beispiele für natürlich vorkommende Isotope sind:
-
Kohlenstoff-12 (12C)
-
Wasserstoff-1 (1H)
-
Sauerstoff-16 (16O)
-
Uran-238 (238U)
-
Kalium-39 (39K)
Isotope künstlichen Ursprungs
Isotope künstlichen Ursprungs sind solche, die durch menschliche Aktivitäten erzeugt werden, entweder durch Kernreaktionen in Laboratorien oder durch induzierte Radioaktivität in Kernreaktoren.
Im Allgemeinen kommen sie auf der Erde natürlicherweise nicht in nennenswerter Zahl vor. Einige Beispiele künstlichen Ursprungs sind:
-
Plutonium-239 (239Pu)
-
Technetium-99m (99mTc)
-
Kobalt-60 (60Co)
-
Jod-131 (131I)
-
Americium-241 (241Am)
Künstliche Isotope werden in einer Vielzahl von Anwendungen eingesetzt, beispielsweise in der Nuklearmedizin für Diagnose und Behandlung, in der Industrie für zerstörungsfreie Tests, in der wissenschaftlichen Forschung und bei der Stromerzeugung in Kernreaktoren.
Darüber hinaus werden einige Isotope künstlichen Ursprungs in militärischen Anwendungen und bei der Herstellung von Atomwaffen verwendet.



