Der Atomkern ist der kleine zentrale Teil des Atoms mit einer positiven elektrischen Ladung, in dem der größte Teil der Atommasse konzentriert ist.
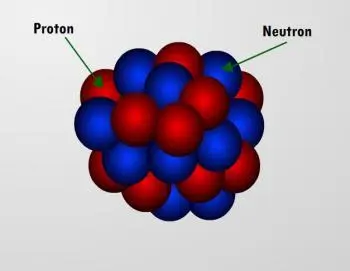
Die wichtigsten subatomaren Teilchen in den Atomkernen sind Protonen und Neutronen oder Nukleonen (mit Ausnahme von Wasserstoffkernen, die nur ein Proton enthalten).
Das gleiche chemische Element wird durch die Anzahl der Protonen im Kern charakterisiert, die die gesamte positive Ladung bestimmt. Diese Zahl wird Ordnungszahl genannt. Die Massenzahl ist die Gesamtzahl der Protonen und Neutronen.
Die Kernphysik ist der wissenschaftliche Zweig, der für die Erforschung und das Verständnis des Atomkerns, einschließlich der Kräfte, die ihn verbinden, und seiner Zusammensetzung verantwortlich ist.
Zusammensetzung des Atomkerns
Der Kern eines Atoms besteht aus Unterteilchen, den sogenannten Nukleonen, die zwei Arten haben können: Protonen und Neutronen.
Fast die gesamte Masse eines Atoms befindet sich im Atomkern. Der Rest der Masse verteilt sich auf die Elektronen, obwohl die Elektronen im Vergleich zu den Neutronen und Protonen sehr wenig wiegen.
Der Durchmesser des Kerns liegt im Bereich von 1,75 fm für Wasserstoff, was dem Durchmesser eines einzelnen Protons entspricht, bis zu etwa 15 fm für die schwersten Atome wie Uran.
Der Atomkern wird durch folgende Zahlen beschrieben:
-
Ordnungszahl Z, die der Anzahl der Protonen entspricht.
-
Anzahl der Neutronen, N.
-
Massenzahl, A = Z + N, die der Anzahl der Nukleonen (Protonen plus Neutronen) entspricht.
Kernbindungen zwischen Protonen
Neutronen sind neutral und Protonen sind positiv geladen. Die Protonen hätten die Tendenz, sich voneinander zu trennen, aber eine Kernkraft hält sie zusammen.
Die Bindungsenergie, die Nukleonen zusammenhält, ist die Energie, die bei Kernfusionsreaktionen entsteht. Durch das Aufbrechen dieser Kraftbindungen kommt es zu einem Masseverlust, der nach Albert Einsteins Theorie in Energie umgewandelt wird. E=mc 2
Entwicklung der Atomtheorie: Atommodelle
Atommodelle sind Theorien, die im Laufe der Geschichte entwickelt wurden. Ziel der verschiedenen Modelle ist es, den Aufbau eines Atoms aus wissenschaftlicher Sicht zu definieren.
Der erste Vorschlag zur inneren Struktur des Atomkerns wurde 1808 vom englischen Chemiker John Dalton ausgearbeitet. Nach Daltons Vorschlag besteht alle Materie aus unteilbaren und unsichtbaren Atomen. Damals war für Dalton die Existenz des Atomkerns unbekannt.
Das erste Modell der inneren Struktur des Atoms erschien 1897 durch Joseph John Thomson. Thomson war der erste, der das negativ geladene Elektron identifizierte.
Durch diese Entdeckung konnte er folgern, dass, wenn Atome eine neutrale Ladung erhalten, positiv geladene Teilchen vorhanden sein müssen, die der Ladung der Elektronen entgegenwirken (es wäre ein Proton).
Ernest Rutherford entdeckte 1911 den Atomkern.
Niels Bohr postulierte 1913, dass Elektronen mit hoher Geschwindigkeit um den mit kinetischer Energie geladenen Atomkern kreisen. Die Elektronen sind auf verschiedenen Kreisbahnen angeordnet, die unterschiedliche Energieniveaus bestimmen.


